Нормальная жесткость воды
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Инженерное ремесло / / Жесткость воды. Умягчение воды. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды. Накипь - отложения в трубах и на стенках емкостей. / / Жесткость воды. Мягкая вода. Жесткая вода. Перевод единиц (градусов) жесткости воды. Нормы жесткости воды. Таблицы значений жесткости воды. Умягчение воды. Как убрать жесткость воды. Поделиться:
| ||||
Жесткость воды - норма и ее влияние на качество жизни
Жесткостью воды называют химическое качество, определяющее объем присутствующих в жидкости примесей соляного кальция и магния. Данный показатель - одно из ключевых качеств воды, которое всегда проверяется в процессе анализа жидкости на предмет пригодности для употребления и бытового применения. Знать о норме показателей и о том, как определить жесткость воды, крайне важно. Знание данного качества жидкости позволит сохранить здоровье и продлить работоспособность техники, так или иначе использующей в своей работе воду.Микробиологические исследования и химические научные опыты определили, что жесткостью воды единицы измерения является содержание в ней большей части солей кальция (Са2+) и несколько меньшего количества магния (Mg2+). На самом деле ситуация обстоит так, что оба эти элементы участвуют в формировании показатель определения жесткости воды и не могут существовать отдельно. В процессе химических реакций с анионами, соли кальция и магний формируют специальные кристаллы жесткости, которые оседают на дно и в дальнейшем используются в качестве биологического материала при проверке воды и ее химического состава.
Таблица наличия в воде катионов металлов и анионов и тест на жесткость воды позволяют узнать детальней о процессе формирования кристаллов жесткости и характере их развития. Влияние на временную жесткость воды и каждого из металлов является различным и зависит от типа жидкости и источника ее происхождения. К примеру такие металлы, как стронций, железо и марганец могут оказывать на состав и степень жесткости воды менее выраженное воздействие и практически не котироваться при анализе и проведении химической экспертизы. Алюминий оказывает влияние на общую жесткость воды, только если кислотность воды достигает нужного уровня, что встречается исключительно в природных водоемах. Из этого следует, что наличие и патогенное воздействие на воду выше указанных металлов при проверке воды бытового использования практически не учитывается из-за крайне низких показателей. Крайне малое влияние на показатель жесткости воды и способы ее устранения также может оказывать барий.
Какие можно выделить типы жесткости воды?
Проверка воды на показатель жесткости проводится в несколько этапов, с учетом типа водоема, в котором был произведен забор, условий содержания жидкости и цели произведенной экспертизы. Как определить жесткость воды в домашних условиях? Чаще всего жесткость при проверке делят на следующие группы:- Жесткость воды общего типа. В процессе определения вида жесткости воды этого показателя выводится единица наибольшей концентрации солей кальция и магния. Данный показатель рассчитывается путем выведения данных о постоянной жесткости воды и непостоянной, временной жесткости некарбонатного типа. Для того чтобы смягчить воду при завышенных показателях общей жесткости используют ионизирующие фильтрующие установки для воды и таблицу жесткости воды.
- Жесткость карбонатного типа. Проверка позволяет выявить наличие в составе воды карбонатных и гидрокарбонатных элементов солей кальция и магния. Такой вид жесткости нередко может называться временным, поскольку устранить завышенные показатели поможет кипячение и вываривание лишних солей. Нагревание воды способствует тому, что гидрокарбонаты и карбонаты кальция и магния раскладываются и становятся осадочным веществом на дне посудины. Такой тип не постоянной жесткости воды превращается в бытовой налет, который нередко можно наблюдать на посуде, в которой часто кипятится вода. Как устранить жесткость воды? Очистить жесткость такой воды можно также путем использования ионизирующих фильтров или механизмов для устранения лишних солей.
- Жесткость воды некарбонатного типа. Данный тип проверки позволяет выявить в воде присутствие кислот солей кальция и магния сильного воздействия. В число таких кислот входят серная, азотная и соляная кислоты. Данный вид не карбонатной жесткости воды нельзя устранить простым кипячением воды и вывариванием патогенных элементов. Постоянную жесткость нередко очищают ионизирующими фильтрами или растворяющими соль веществами.
В чем измеряется жесткость воды? Стоит отметить, что мировая таблица единиц измерений имеет несколько разных обозначений для типов и разновидностей жесткости. Каждая из этих единиц взаимосвязана с остальными. На территории постсоветского пространства до их пор используют единицу моль для обозначения показателя определения общей жесткости воды. В европейских государствах могут нередко использовать такие обозначения как do, dH, fo. В США используется обозначение ppm CaCO3.
Закажите бесплатно консультацию эколога
Почему вода становится жесткой?
Изначально стоит отметить, что вся жидкость мирового океана имеет определенные показатели жесткости, то есть в ее химическом составе неизменными веществами являются соли кальция и магний, а также несколько других щелочных металлов и земельных веществ. От чего зависит жесткость воды? Такой состав жидкости обуславливается тем, что минеральные воды изначально проистекают на поверхность из залежей многовековых пластов известняка и разных типов доломита. Соли кальция и магний попадают в воду путем химической связи диоксида углерода с группой минералов. Процесс выветривания и химической деформации горных пород приводит к образованию кристаллов жесткости в воде. Их источники - природные залежи известняков, гипса и доломитов. Ионизирующие вещества многовековых залежей, через которые протекает вода, могут появляться из-за еще не изученных биологических реакций и процессов в глубине плит на месте, из которого проистекает жидкость. Добавлять в состав побочные минералы и кристаллы способны и другие химические примеси, сточные воды, элементы и организмы окружающей среды.
Что показывает таблица жесткости воды?
Большинство минерализованной воды, которая попадает в открытые водоемы и становится источником жидкости для бытового и промышленного существования, имеет жесткость, превышающую показатели 75-85%. Как проверить жесткость воды в домашних условиях? Такой высокий показатель свидетельствует о том, что вода содержит повышенное количество солей кальция и магния из-за наличия ионизирующих горных пород. С учетом источника минеральной воды, в ряде случаев уровень жесткости не превышать 60%. Важно отметить, что от показателя минерализации напрямую зависит наличие ионов кальция. Жесткость воды, норма для питьевой воды такова: в открытых водоемах с пресной водой уровень содержания кальция не поднимается выше, чем 1 г из расчета на литр воды; соленые водоемы могут содержать примерно 10-15 г солей кальция на литр.
Стоит сказать, что показатель жесткости и концентрация солей кальция в воде напрямую определяется типом воды и местом ее расположения. Так, поверхностные воды нередко могут иметь наиболее низкие показатели жесткости, тогда как подземные водоемы или озера могут быть максимально жесткими и насыщенными солями. Концентрация солей в воде находится также в прямой зависимости от времен года и сезонных осадков. В конце зимы наличие кристаллов жесткости может увеличиваться, однако в период таяния снега и выпадения мягкой воды в виде снега и дождя кристаллы солей разбавляются и показатели жесткости заметно снижаются. Максимально жесткой вода считается в океанах и морях, где концентрация солей является максимально высокой.
Как может влиять показатель жесткости на качество жидкости?
Жесткость воды и ее показатели являются позволительными и удовлетворительными, в зависимости от цели использования жидкости. Если вода предназначается для использования в бытовых целях, показатели ее жесткости не должны превышать 2-6 мг на литр. Такая концентрация солей кальция считается максимально допустимой для бытового использования и не вредит человеческому здоровью. Прибор для измерения жесткости воды показывает, что промышленные цели использования воды могут повышать показатель жесткости до 10 мг на литр, однако не более этих рамок. Важно отметить, что вода с высоким показателем жесткости является, как правило, слишком горькой и имеет характерный запах, а также может оказывать патогенное воздействие на пищеварительную систему и желудочно-кишечный тракт, что делает ее непригодной для использования в пищевых или бытовых целях.
Важно сказать, что Всемирная организация здравоохранения проводит множество исследований и до сих пор не может найти единого ответа на вопрос о том, насколько велика патогенность влияния жесткой воды на человеческий организм и полезно ли постоянное использование в пищу только мягкой и фильтрованной воды без примесей солей и кальция. Предварительные исследования говорят о том, что некоторые типы вод с повышенным показателем жесткости могут провоцировать сердечно-сосудистые заболевания, проблемы с суставами и каменные болезни.
Специалисты компании ЭкоТестЭкспресс производят качественную аналитику жесткости воды в зависимости от требуемых целей и особенностей проверки. Связаться с нами, оставить заявку можно в онлайн-форме ниже.
Рассказываем о жесткости воды. - VodaLab

Жесткая вода чаще всего ассоциируется с накипью на дне чайника или ощущением мыла на руках после мытья рук, некоторые испытывают ощущение «жестких волос». По этому критерию люди обычно оценивают качество воды. В этой статье мы рассмотрим жесткость со стороны физики и химии, изучим ее свойства, разновидности, влияние на здоровье человека и способы ее устранения жесткости воды.
Соли жесткостиЭффект жесткой воды
Жесткость воды — это концентрация растворённых в ней солей магния (Mg) и кальция (Ca): гидрокарбонатов, хлоридов и сульфатов. Проще говоря, жесткой называется вода, содержащая в себе большое количество солей. Почему воду назвали «жесткой»? Женщины в старину стирали вещи на берегу рек и озер, в воде которых содержат кальций, отчего ткань становилась жесткой на ощупь.
Жесткость воды делится на 3 вида:
- Карбонатная, т.е. временная. Она ликвидируется с помощью обычного кипячения воды и обусловлена гидрокарбонатами кальция и магния Са(НСО3)2; Mg(НСО3)2.
- Некарбонатная, т.е. постоянная. Возникает из-за присутствия других солей, например CaSO4, Ca(Cl)2, MgSO4, Mg(Cl)2. При кипячении воды не устраняется.
- Общая. Представляет собой суммарную концентрацию ионов кальция и магния. Представляет собой сумму карбонатной и некарбонатной жесткости.
Единицы измерения жесткости:
Не существует единой единицы измерения жесткости. В России, в соответствии с Госстандартом, в качестве единицы жесткости воды установлен моль на кубический метр (моль/м3). В Германии — 2.8DH°; во Франции — 5F°; в Америке — 50.05 ppm CaCO3.
Классификация воды по жесткости:
| Характеристика | Жесткость, мг-экв/л |
| очень мягкая вода | до 1,5 мг-экв/л |
| мягкая вода | от 1,5 до 4 мг-экв/л |
| вода средней жесткости | от 4 до 8 мг-экв/л |
| жесткая вода | от 8 до 12 мг-экв/л |
| очень жесткая вода | более 12 мг-экв/л |
Согласно требованиям СанПиН 2.1.4.1074-01 жесткость питьевой воды должна быть не выше 7 мг-экв/л.
Влияние на здоровье человека:
Как же влияет жесткая вода на наш организм? Медики связывают появление мочекаменной болезни именно с этой особенностью воды. Но на данный момент официального подтверждения этой гипотезе нет. Но мы знаем, что слишком жесткая вода неблагоприятно влияет на органолептические свойства воды, придавая ей горьковатый вкус. Также жесткая вода сушит нашу кожу и волосы. Однако, полностью переходить на мягкую воду не рекомендуется. Наш организм нуждается в солях кальция и магния для укрепления сердечно-сосудистой системы. А вот комнатные растения лучше поливать мягкой или талой водой.
Способы борьбы с жесткой водой:
Для смягчения жесткости воды специалисты рекомендуют приобрести умягчители, которые являются самыми эффективными в борьбе с солями жидкости. Также существует несколько способов смягчения воды в домашних условиях, самым простым и привычным из которых является кипячение воды.
Для борьбы с постоянной жёсткостью воды используют такой метод, как вымораживание льда. Необходимо просто постепенно замораживать воду. Когда примерно 90% жидкости превратится в лед, нужно разморозить его обратно, а соли останутся в оставшейся незамороженной жидкости.
При выборе степени жесткости воды лучше придерживаться середины. Самым оптимальным является использование воды средней жесткости для приготовления пищи и мягкой воды для гигиенических процедур. А чтобы ваша бытовая техника не страдала от повышенной жесткости, лучше приобрести умягчитель.
Заказать анализ воды на жесткость вы можете на нашем сайте vodalab.ru. Каждый из представленных на сайте анализов содержит исследование воды на жесткость.
О других загрязнителях воды, таких как железо, мутность и марганец, вы также можете узнать подробнее в нашем блоге.
ее норма на территории РФ по ГОСТу. Какая вода считается нормальной для питья и какая бутилированная вода самая мягкая?

Каждый обладатель стиральной или посудомоечной машины не раз сталкивался с проблемой жесткости воды. На деталях агрегатов образовывается накипь, которая может ухудшить работу или вовсе вывести механизм из строя. Поэтому возникла необходимость в измерении и регулировке жесткости влаги в жилых домах. Кроме того, целесообразно наблюдать за качеством жидкости не только в целях правильного использования техники, но и для сохранения здоровья человека.
Питьевая вода тоже имеет примеси, которые могут плохо влиять на организм человека, поэтому очень важно знать стандарты жесткости, определенные ГОСТом. В каждой стране существуют свои стандарты и способы определения вредных компонентов в питьевой и технической жидкости. Чтобы найти решение проблемы качества воды, нужно вначале разобраться, что значит «повышенная жесткость воды».
Что это такое?
Жесткость бытовой и питьевой воды обусловлена содержанием двух разновидностей соли – растворенной и нерастворенной. Количество примесей в жидкости может быть как слишком высоким (жесткая вода), так и очень низким (мягкая вода). Повышенная концентрация солей может серьезно навредить работе таких внутренних органов человека, как почки, печень, сердце, а также коже.
Кроме того, если пить воду с большим количеством вредных веществ, можно очень легко заработать отравление, расстройство пищеварительной системы и даже изменение цвета кожи.
На бытовой технике соли тоже оставляют свой след – содержащиеся в воде магний и кальций образовывают прочную накипь на трубах и внутренних деталях машин, такой налет практически невозможно очистить. Приведем несколько признаков излишней жесткости влаги:
- горькая и «железная» на вкус;
- непрозрачная;
- иногда жидкость имеет разные оттенки;
- может обладать запахом ржавчины.
Если же примесей в питьевой жидкости недостаточно, это может нарушить водно-щелочной баланс в организме человека, что тоже очень плохо скажется на здоровье.
Какая считается нормальной?
По составу вода делится на три типа: жесткая, мягкая и средняя. Жесткой считается вода из морей, океанов и других соленых источников, такую влагу необходимо опреснять. Мягкий тип жидкости – это кипяченая, дождевая или дистиллированная. Вода из родника и водопровода обычно обладает средней жесткостью.
Норма поставляемой в дома и квартиры жидкости определяется несколькими регламентами, такими как ГОСТ, СанПиН и ТУ. Ранее параметры примесей в жидкости определяли через содержание кальция и магния в миллимолях на литр, но в 2014 году в России ввели новый способ измерения, называемый «градус жесткости», он обозначается как °Ж.
Старое и новое понятия очень похожи между собой, изменился только объем исследуемой жидкости. Если говорить проще, то 1°Ж – это половина миллимоля на литр.
В разных странах примеси определяют другими параметрами, например, в Германии единицей измерения является dH, а во Франции fo. Но самой простой является система измерения из США – там жесткость воды измеряют в ppm (Parts Per Million или количество частиц на миллион молекул). Рассмотрим допустимые уровни примесей по ppm:
- идеальная вода для питья – это та, которая пропущена через фильтр обратного осмоса, содержание примесей в ней составляет 0-50 ppm;
- в оптимальной жидкости, очищенной угольным фильтром, показатель ppm должен быть от 50 до 170, её также можно использовать как питьевую;
- ограниченно допустимая вода для доставки по трубам, показатель ppm не должен превышать 300;
- жесткая питьевая вода из источников, количество примесей в ней может быть до 400 ppm;
- предел приемлемости питьевой влаги – 500 ppm;
- вся жидкость, в которой содержание молекул более чем 500 ppm, опасна для жизни.
Действующий на территории РФ нормируемый показатель жесткости имеет различия с международными стандартами качества. Например, рекомендации Всемирной организации здравоохранения позволяют использовать более жесткую воду, чем допускает СанПиН.
Но если рассматривать настоящее водоснабжение в столице России, то показатели жесткости едва ли соответствуют требованиям ВОЗ.
В других странах качество воды в мегаполисах может сильно отличаться, например, в Нью-Йорке уровень ppm в водопроводе очень низкий, а вот в Париже вода имеет больше примесей, чем в Москве.
Самая мягкая вода в бутылках
Живительная влага является одним из важнейших источников полезных минеральных веществ для организма человека. Качественная вода не только утоляет жажду, но и обладает несколькими лечебными свойствами. Приведем несколько примеров влияния чистой питьевой воды.
- Очищенная жидкость улучшает состояние кожи, делает ее мягкой и эластичной.
- При помощи влаги организм выводит из себя шлаки и другие загрязнения. Работа почек напрямую зависит от качества воды.
- Сердечно-сосудистая система улучшает свою работу при достаточном количестве полезных веществ в жидкости.
- Органы желудочно-кишечного тракта также будут здоровее, если пить качественную питьевую воду.
Каждое из перечисленных полезных свойств относится только к чистой минеральной влаге. Обычная жидкость из-под крана чаще всего обладает большим количеством вредных примесей, таких как ржавчина, песок, а также соли кальция и магния.
Поэтому самым разумным выбором для человека, который заботится о своем здоровье, будет бутилированная живительная влага.
Вот несколько компаний, предоставляющих качественную минеральную воду на территории РФ:
- «Нарзан»;
- «Серебряная роса»;
- BonAqua;
- «Ессентуки»;
- «Бон Буассон»;
- «Сарова»;
- «Боржоми»;
- «Лысогорская».
Лучшая по продажам влага – это «Боржоми», она производится в Грузии и пользуется высоким спросом не только в России, но и во всем мире.
Как определить?
СанПиН ставит достаточно высокие планки качества питьевой воды, поставляемой водопроводом, но многие компании часто относятся к этому пренебрежительно и экономят на фильтрационных системах. Поэтому потребители имеют полное право предъявлять претензии к некачественной жидкости.
Самые поверхностные признаки содержания во влаге вредных примесей – это металлический привкус и мутность. Отварные продукты становятся жесткими от такой воды, а на вымытых волосах остается белый налет. Кроме того, если жидкость из водопровода не может размягчить мыло или после кипячения в посуде остается много накипи – это также является отличительной чертой высокого показателя ppm.
Но для того чтобы точно судить о допустимых нормах водопровода, таких простых тестов недостаточно.
Чтобы определить жесткость воды из-под крана, можно отнести ее в лабораторию СЭС на проверку. Там на микробиологическом уровне могут обнаружить все вредные органические составляющие, ядовитые нитраты или даже микроорганизмы. Но услуги лаборатории МГУ могут обойтись в круглую сумму, а вот в местном лабораторном центре анализ будет дешевле, если не потребуется расширенное исследование воды. Чтобы самостоятельно сделать тестирование качества водоснабжения, можно провести анализ с помощью тест-полоски на жесткость воды.
Как умягчить?
Способов снижения уровня жесткости воды достаточно много, но каждый из них подходит для разных ситуаций. Рассмотрим варианты умягчения жидкости.
- Термическая обработка жидкости в домашних условиях. Самый простой способ снизить содержание вредных солей – это кипячение. Но такой метод подходит лишь для небольших объемов влаги, ведь примеси устраняются не полностью. К тому же, если очищать влагу таким способом на большом предприятии, кипячение увеличит вредные свойства компонентов.
- Чтобы защитить бытовую технику, можно применить специальные средства для смягчения. Например, реагент «Калгон» препятствует оставлению соляного налета на деталях стиральной машины. Этот способ очищения подходит только для техники, фильтровать питьевую воду, используя такой умягчитель, нельзя.
- Чтобы провести умягчение влаги из скважины, можно использовать электромагнитный метод. С помощью специального механизма из воды удаляются лишние шлаки, но такой фильтр подходит только для жесткой воды, используемой в технических целях.
- Один из самых дешевых способов провести очистку жидкости – это установить кувшин с ионообменными смолами. Насыщенность смолы постепенно снижается и требует регулярной регенерации. Такой способ не подходит для фильтрации питьевой воды, только для технической и бытовой жидкости.
- Для умягчения питьевой воды можно использовать два разных фильтра: обратный осмос и проточный под мойку. Первый совершает очистку от солей и других, вредных для организма компонентов. Мембрана обратноосмотического фильтра способна исправно работать на протяжении 1,5 лет, а картриджи подлежат замене каждые 6 месяцев. Второй фильтр совершает замену ионов кальция и магния на неопасные для человека ионы натрия. Процесс обеспечивает специальная смола внутри дополнительного картриджа.
Регулирование жесткости влаги – не самое дешевое удовольствие, но от этого зависит здоровье каждого человека.
Что такое жесткость воды: уровень и методы определения
Жесткость – параметр качества воды
Жесткость питьевой воды – одна из качественных характеристик воды, которое обуславливается наличием в воде солей двух щелочноземельных металлов - кальция и магния. Жесткость имеет значение для оценки качества любой используемой воды, технической, питьевой и воды, используемой для нужд промышленных предприятий с заданными характеристиками.
Наибольшее влияние на уровень жесткости воды оказывает количество катионов кальция, несколько в меньшей степени – магния. Катионы стронция, железа и марганца также оказывают влияние на жесткость воды, однако их вклад в общую жесткость воды так мало, что на практике обычно пренебрегают их значениями.
Общая жесткость определяется суммой временной и постоянной жесткостью воды.
Постоянная жесткость воды – кальциевые и магниевые соли соляной, серной, азотной кислот, т.е. сильных кислот. Такие соли жесткости в воде при кипячении не выпадают в осадок и не кристаллизуются в виде накипи.
Временная жесткость воды – показатель, наличия в воде карбонатов и гидрокарбонатов кальция и магния, которые при кипячении и показателях рН больше 8,3, практически полностью выпадают в хлопьевидный осадок, кристаллизуются в виде накипи или образуют пленку на поверхности воды.
Как соли кальция и магния попадают в природную воду, ведь вода, выпадающая в виде осадков, как и талая вода, не содержат солей?
Это происходит следующим образом: вода, напитывается солями, содержащимися в известняках, гипсах и доломитах залегающих в толщах земли.
Это основной источник этих солей. Кроме этого, выветривание горных пород, также может оказывать влияние на карбонатную жесткости воды.
Согласно методам определения жесткости воды по гидрохимии считается:
- 0-4 мг-экв./л – мягкая вода
- 4-8 мг-экв./л – средней жесткости
- 8-12 мг-экв./л – жесткая вода
- Больше 12 мг-экв./л – очень жесткая
Это касается оценки общей минерализации воды, но для питьевой воды российский СанПиН определяет предельно допустимые концентрации 0-7 мг-экв/л.
Специалисты в области фильтрации условно делят жесткость питьевой воды так:
- 0-1,5 мг-экв/л – мягкая вода
- 1,5-2 мг-экв/л – оптимальная питьевая вода
- 2-5 мг-экв/л – жесткая вода
- 5-7 мг-экв/л – сверхжесткая вода
- Больше 7 мг-экв./л – не питьевая вода, за пределами рекомендованных значений.
Можно разделить природную воду на поверхностную и подземную.
Поверхностная вода обычно имеет меньшую жесткость, поскольку она разбавляется в значительной степени осадками и талыми водами. Этим объясняется и факт сезонных изменений показателей общей жесткости для поверхностных вод.
Состав подземных вод более постоянен, и обычно имеет большие значения, чем у поверхностной воды, по общей жесткости.
Питьевая вода должна иметь оптимальный состав по количеству солей жесткости.
Слишком много солей – риск возникновения мочекаменной болезни, заболеваний костей, суставов. Слишком мало солей – соли вымываются из организма, кости приобретают большую ломкость, возрастает риск заболеваний суставов, сосудов.
По мнению некоторых исследователей, в регионах с пониженным уровнем жесткости воды, также возрастает риск сердечнососудистых заболеваний. Это подтверждается статистикой по странам Европы и Северной Америке, исследованиям в российских регионах с разными средними показателями по жесткости воды.
Также жесткая вода образует накипь, что приводит к уменьшению сроков службы бытовой технике, преждевременному износу водонагревательного оборудования, портит сантехническое оборудование.
Вода, уровень жесткости которой меньше двух мг-экв/л способна сильнее, чем более жесткая вода оказывать на водопроводные трубы коррозийное воздействие, поскольку имеет более низкую щелочность.
Поэтому, в ряде случаев, особенно в теплоэнергетике, иногда приходится проводить дозирование карбонатной жесткости воды с целью достижения оптимального соотношения между коррозионной активностью воды, ее водородному показателю и содержанию кальция и магния.
В настоящее время ряд специалистов, ссылающиеся на данные ВОЗ, утверждают, что имеющаяся статистика не позволяет однозначно считать мягкую и жесткую воду опасной для здоровья человека. И все же имеющиеся данные подтверждают зависимость водно-солевого баланса в организме человека от этих факторов, а отсутствие нормативной доказательной базы на уровне Всемирной Организации Здравоохранения, не причина закрывать глаза на качество питьевой воды по количественным показателям солей жесткости - солей кальция и магния.
Закажите консультацию специалиста компании Гейзер
Остались вопросы? Мы всегда готовы предоставить консультацию по всем вопросам очистки воды!
Жесткость воды: что это, влияние на организм, показатели жесткости - статьи
Люди давно заметили, что иногда после стирки мылом одежда становится жестче. Они связывали такое состояние ткани с качеством воды, а позже - с ее составом. Так возник термин «жесткая вода», характеризующий присутствие в растворах кальция и магния. Соединениям этих минеральных веществ с кислотами и дали название «соли жесткости».
Говоря о жесткости воды, ее подразделяют на постоянную и временную. Последняя легко устраняется с помощью кипячения. При этом соли угольной кислоты, выпадающие в осадок, создают накипь на стенках сосудов или пленку на поверхности воды. Постоянную жесткость придают воде соединения кальция и магния с соляной, серной, азотной кислотами. При кипячении их соли не выпадают в осадок и не образуют накипи.
Влияние жесткой и мягкой воды на человека и бытовые приборы
Слишком жесткая вода отрицательно воздействует на технические устройства:
- разрушает теплотехническое и сантехническое оборудование: на стенках водопроводной и отопительной систем нарастают известковые отложения, уменьшающие напор, и возникает необходимость менять трубы;
- увеличивает расход тепла на нагревание, так как у накипи низкая теплопроводность;
- образуя накипь на ТЭНах, вредит бытовым приборам, что сокращает срок их службы из-за сгорания нагревательных элементов;
- из-за слабого вспенивания приводит к перерасходу моющих веществ.
Бывает вред для оборудования и от слишком мягкой, низкощелочной воды. Если ее показатель жесткости ниже 2 мг-экв/л, то в водопроводных трубах повышается коррозия внутренних металлических поверхностей и они быстро выходят из строя.
Сильная жесткость употребляемой воды негативно влияет на наше здоровье:
- сушит кожу, вызывая появление зуда, шелушения, перхоти и аллергических реакций, удаляет ее защитный слой, открывая дорогу микроорганизмам;
- ликвидирует сальную пленку на голове и теле, что приводит к их быстрому загрязнению;
- становится виновником желудочно-кишечных проблем;
- способствует накоплению в органах токсинов;
- создает в организме избыток кальция и магния, нарушающий работу сердца и сосудов;
- воздействует на костную систему, уменьшая суставную жидкость и снижая тем самым подвижность человека;
- увеличивает вероятность возникновения мочекаменной болезни, создавая слишком сильную солевую нагрузку на мочеполовую систему.
Однако и слишком малое содержание солей жесткости вредно для человека:
- При низком содержании в воде солей кальция происходит вымывание его из организма, вызывающее ломкость костей и разрушение зубов, а также заболевания суставов и сосудов.
- В результате нехватки кальция и магния возникают сердечно-сосудистые проблемы.
- Недостаток поступления кальция из воды и пищи заставляет организм забирать этот элемент из костей. Большая его часть не усваивается и идет на образование камней во внутренних органах, а также костных шпор.
Нормы жесткости воды
Как указано в ГОСТе 31865-2012, в Российской Федерации жесткость измеряется в градусах (1 ºЖ равен 1 мг-экв/л). Это соответствует концентрации кальция или магния, эквивалентной 0,5 миллимоля на литр.
Исходя из присутствия солей жесткости, вода считается:
- мягкой - к ней относят дистиллированную и кипяченую, дождевую и талую воду;
- средней – она поступает из централизованных водопроводных систем, артезианских скважин и родников;
- жесткой - ее получают из скважин, где воде растворены гипс, известняк, доломиты;
- сильно жесткой - ее добывают из соленых водоемов, а затем опресняют.
С какой жесткостью воду можно пить
СанПиН России указывает предельно допустимые концентрации солей жесткости в питьевой воде (0-7 мг-экв/л). Если она превышает 7 мг-экв./л, то такую воду нельзя использовать как питьевую, не опасаясь серьезных проблем во всем организме: от кожных и волосяных покровов до сердечно-сосудистой, костной, мочеполовой и желудочно-кишечной систем. Да и для технического применения не подходит вода, в которой излишняя концентрация солей жесткости портит оборудование.
Как замерить жесткость воды
В лабораторных условиях определением жесткости занимаются с помощью разных методов. Самым доступным, а потому широко применяемым является титрование. К сожалению, точность этого способа не слишком высока.
Более точные данные жесткости питьевой воды показывает прибор АКМС-1. Но наивысшую точность дает метод атомной спектрометрии. Однако приборы, работающие на его основе, стоят очень дорого.
Измерение жесткости воды в домашних условиях
Есть ряд домашних методов определения жесткости воды, но все они приблизительны:
По сильному или слабому пенообразованию - намылив руки, можно увидеть, хорошо или плохо пенится и смывается мыло, а значит мягкая или жесткая вода.
По образованию слоя накипи при кипячении - чем он толще, тем жестче вода. Этот способ не подходит для экспресс-теста, так как требует длительного времени.
По вкусу воды - жесткая обычно горьковатая.
По цвету индикатора жесткости, то есть бумажки, изменяющей окраску при разной концентрации солей в жидкости. Этот тест более точный.
С помощью TDS-метров, довольно компактных приборов, измеряющих суммарное количество солей, растворенных в воде.
Что же делать, чтобы избежать проблем, вызванных употреблением воды, которая представляет опасность для здоровья? В первую очередь, следует относиться к этому вопросу серьезно и не пренебрегать изучением данных о воде, которую приходится пить. Во избежание серьезных заболеваний нежелательно постоянно употреблять как слишком жесткую, так и очень мягкую воду. Для домашней техники нужно использовать смягчители воды, а от управляющих компаний добиваться безопасной работы водопровода.
Жесткость воды - MEL Chemistry
Реагенты
Безопасность
- Наденьте защитные перчатки и очки.
- Проведите эксперимент на лотке.
- Поставьте плиту на пробковую подставку для горячих горшков. Не трогайте плиту после эксперимента - дождитесь, пока она остынет.
- Перед зажиганием свечи снимите защитные перчатки.
Общие правила безопасности
- Не допускайте попадания химикатов в глаза или рот.
- Не подпускайте маленьких детей, животных и лиц без защитных очков к экспериментальной зоне.
- Храните этот экспериментальный набор в недоступном для детей младше 12 лет.
- После использования очистите все оборудование.
- Убедитесь, что все контейнеры полностью закрыты и правильно хранятся после использования.
- Убедитесь, что все пустые контейнеры утилизированы надлежащим образом.
- Не используйте оборудование, которое не входит в комплект поставки или не рекомендовано в инструкции по эксплуатации.
- Не заменяйте продукты в оригинальной упаковке.Немедленно утилизируйте.
Общая информация по оказанию первой помощи
- В случае попадания в глаза: промыть глаза большим количеством воды, при необходимости держать глаз открытым. Немедленно обратитесь за медицинской помощью.
- При проглатывании: прополоскать рот водой, выпить свежей воды. Не вызывает рвоту. Немедленно обратитесь за медицинской помощью.
- В случае вдыхания: вывести человека на свежий воздух.
- В случае контакта с кожей и ожогов: промыть пораженный участок большим количеством воды в течение не менее 10 минут.
- В случае сомнений немедленно обратитесь за медицинской помощью. Возьмите химическое вещество и контейнер с собой.
- В случае травмы всегда обращайтесь к врачу.
Консультации для взрослых
- Неправильное использование химикатов может привести к травмам и ущербу для здоровья.Выполняйте только те эксперименты, которые указаны в инструкции.
- Этот экспериментальный набор предназначен только для детей старше 12 лет.
- Поскольку способности детей очень сильно различаются, даже в пределах возрастных групп, взрослые должны проявлять осмотрительность при выборе экспериментов, подходящих и безопасных для них. Инструкции должны позволять руководителям оценивать любой эксперимент, чтобы установить его пригодность для конкретного ребенка.
- Наблюдающий взрослый должен обсудить предупреждения и информацию о безопасности с ребенком или детьми до начала экспериментов. Особое внимание следует уделять безопасному обращению с кислотами, щелочами и легковоспламеняющимися жидкостями.
- В зоне, окружающей эксперимент, не должно быть никаких препятствий и места для хранения продуктов. Он должен хорошо освещаться и вентилироваться и находиться рядом с водопроводом.Должен быть предусмотрен прочный стол с термостойкой столешницей.
- Вещества в неповторяемой упаковке должны быть израсходованы (полностью) в течение одного эксперимента, то есть после вскрытия упаковки.
Часто задаваемые вопросы и устранение неисправностей
Раствор в колбе не мутнеет после шага 6.
Возможно, раствор в колбе еще недостаточно нагрелся.Подождите 5 мин. дольше.
Как пользоваться термостикером?
Наклейте наклейку на колбу или плиту. При температуре около 60–70 o С треугольник меняет цвет с черного на желтый, чтобы предупредить о том, что объект, к которому он прикреплен, горячий и к нему нельзя прикасаться! Вы можете брать или дотрагиваться до колбы, только когда она остынет и треугольник снова станет черным.
Другие эксперименты
Пошаговая инструкция
- Налейте воду в колбу до отметки «40».
- Добавьте туда весь 0,2 М раствор хлорида кальция CaCl 2 из флакона.
- Возьмите топливную плиту и поставьте на нее свечу. Снимите защитные перчатки и зажгите свечу. Установите диффузор пламени на плиту, как показано.
- Установите колбу на диффузор пламени. Подождите 15 мин.
- Вылейте весь 0,3 М раствор гидрокарбоната натрия NaHCO 3 из флакона.
- Вода в колбе станет мутной.
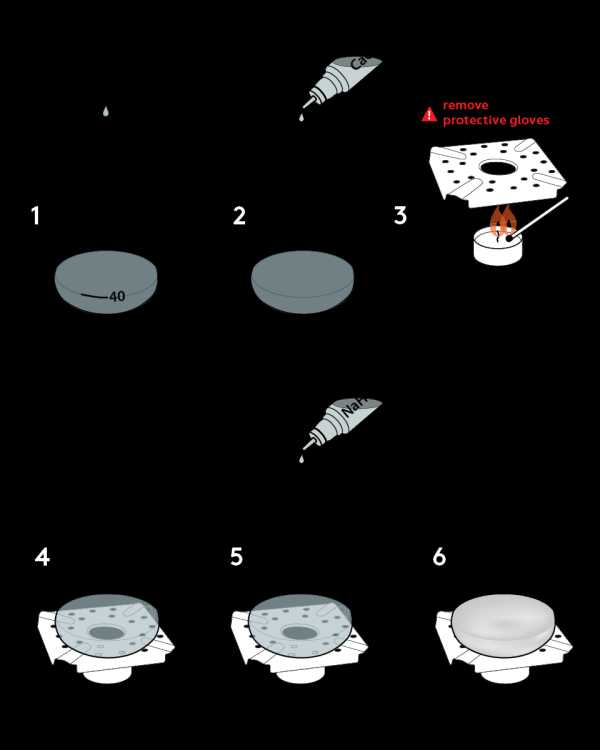
Утилизация
Утилизировать твердые отходы вместе с бытовым мусором.Вылейте растворы в раковину. Смыть большим количеством воды.
Научное описание
Что такое жесткость воды?
Жесткость воды - это величина, отражающая количество растворенных в воде солей кальция, магния и железа. Есть временная твердость (которую можно удалить) и постоянная твердость. Временная твердость обусловлена бикарбонатами кальция и магния (Ca (HCO 3 ) 2 и Mg (HCO 3 ) 2 ), а постоянная жгут - их сульфатами ((CaSO 4 и MgSO 4 ) и хлориды (CaCl 2 и MgCl 2 ).
Таким образом, жесткая вода - это вода, которая одновременно содержит много солей кальция, магния и железа.
Почему мы добавляем СаCl 2 ?
Добавляя в воду хлорид кальция CaCl 2 , мы искусственно увеличиваем ее жесткость. Как упоминалось выше, CaCl 2 вызывает постоянную (то есть не устраняемую кипячением) жесткость воды. И первая часть эксперимента продемонстрировала этот факт: при кипении на стенах не происходит заметных осадков.
Что происходит, когда мы добавляем NaHCO 3 ?
Добавление бикарбоната натрия NaHCO 3 дает образование бикарбоната кальция в растворе:
2NaHCO 3 + СаCl 2 ↔ Ca (HCO 3 ) 2 + 2NaCl
А из-за образования Ca (HCO 3 ) 2 жесткость нашей воды становится временной - теперь ее можно удалить кипячением.
Что происходит при нагреве воды?
Когда мы нагреваем воду, достаточно растворимый бикарбонат кальция превращается в плохо растворимый карбонат:
Ca (HCO 3 ) 2 → CaCO 3 ↓ + CO 2 ↑ + H 2 O
Белый налет на дне и стенках колбы - это карбонат кальция.
Почему образуется накипь и как ее удалить?
Накипь (или известковый налет) представляет собой нерастворимый карбонат кальция CaCO 3 , который выпал в осадок при термическом разложении бикарбоната кальция Ca (HCO 3 ) 2 :
Ca (HCO 3 ) 2 → CaCO 3 ↓ + CO 2 ↑ + H 2 O
Хотя толстый серый слой накипи не делает посуду красивее, он не приносит вреда. Кроме того, он может удалить излишнюю жесткость водопроводной воды.Кроме того, накипь с чайников и кастрюль легко удаляется, промывая их лимонной кислотой С 6 H 8 O 7 раствор:
3CaCO 3 + 2С 6 H 8 O 7 → Ca 3 (C 6 H 5 O 7 ) 2 + 3CO 2 + 3H 2 O
В результате реакции образуется цитрат кальция Ca 3 (C 6 H 5 O 7 ) 2 , который хорошо растворяется в воде.
Учить больше
Грязно-бежевый цвет окалины обусловлен присутствием оксида железа Fe 2 O 3 . Водопроводная вода содержит некоторое количество железа в виде ионов Fe 2+ , но при кипячении оно выпадает в осадок.
Интересно, что по химическому составу накипь имеет тот же химический состав, что и природный известковый налет. Иногда они находят целые горы, образованные из этого минерала. Обычно в таких массивных природных образованиях есть многочисленные пещеры - излюбленные спелеологами! Эти пещеры легко образуются в известняке: даже слабокислая природная вода на своем пути растворяет карбонаты, образуя любопытные ходы в минерале.
Кроме того, карбонат кальция является основным компонентом обычного мела, который используется для письма на доске или рисования на асфальте. Кроме того, мел используется в качестве пищевой добавки - белого пищевого красителя Е170.
Напомним, что карбонат кальция - это вещество, придающее яичной скорлупе твердость. В наборе MEL Chemistry есть эксперимент «Химия пищи», в котором карбонат кальция растворяют обычным уксусом (см. Эксперимент «Резиновое яйцо»).
Как смягчить воду?
Вода с низким содержанием солей кальция и магния называется мягкой.А процесс снятия жесткости с воды смягчается.
Самый простой способ смягчить воду, как показывает наш эксперимент, - это кипячение. При нагревании бикарбонаты кальция и магния (Ca (HCO 3 ) 2 и Mg (HCO 3 ) 2 ) подвергаются термическому разложению:
Ca (HCO 3 ) 2 → CaCO 3 ↓ + CO 2 ↑ + H 2 O
Mg (HCO 3 ) 2 → MgCO 3 + CO 2 ↑ + H 2 O
MgCO 3 + H 2 O → Mg (OH) 2 ↓ + CO 2 ↑
Кипячение (термическое умягчение) - древнейший способ умягчения воды для бытовых нужд.Конечно, этот процесс снимает лишь временную (карбонатную) жесткость. Постоянная жесткость сохраняется, как мы можем наблюдать в первой части нашего эксперимента: вода, насыщенная хлоридом кальция CaCl 2 , не оставляет осадка при кипячении.
Дистилляция тесно связана с кипячением. Следовательно, во время перегонки испарившаяся жидкость конденсируется на охлаждаемой поверхности и, таким образом, собирается в виде капель. Вода, очищенная таким способом, называется дистиллированной водой и не содержит ионов металлов.Дистиллированная вода из-за низкой минерализации не подходит для питья, так как она «вымывает» из организма минералы. Однако дистиллированная вода широко используется в науке и промышленности.
Ниже вы можете найти более подробную информацию о современных методах смягчения воды.
Учить больше
Очевидно, что кипячение - один из самых простых способов смягчить воду. Однако у такого процесса есть существенные недостатки, а именно низкая эффективность и высокое потребление энергии.
Другой способ смягчить воду - использовать реагенты. Они переводят ионы магния и кальция в нерастворимую форму, добавляя определенные химические вещества - например, гидроксид кальция Ca (OH) 2 (процесс называется размягчением извести):
Ca (OH) 2 + Ca (HCO 3 ) 2 → 2CaCO 3 ↓ + 2H 2 O
Mg (HCO 3 ) 2 + 2Ca (OH) 2 → Mg (OH) 2 ↓ + 2CaCO 3 + 2H 2 O
Смягчение извести, как и кипячение, устраняет только карбонатную жесткость.Для устранения постоянной (некарбонатной) жесткости необходимо более глубокое умягчение воды, поэтому в дополнение к гашеной извести используют карбонат натрия Na 2 CO 3 :
Ca 2+ + Na 2 CO 3 → CaCO 3 ↓ + 2Na +
Mg 2+ + Na 2 CO 3 → MgCO 3 ↓ + 2Na +
MgCO 3 + Ca (OH) 2 → Mg (OH) 2 ↓ + CaCO 3 ↓
Для еще более эффективного удаления ионов кальция и магния из воды используют «большие пушки» - фосфат натрия Na 3 PO 4 :
3Ca 2+ + 2Na 3 PO 4 → Ca 3 (PO 4 ) 2 ↓ + 6Na +
3Mg 2+ + 2Na 3 PO 4 → Mg 3 (PO 4 ) 2 ↓ + 6Na +
Недостатком этого метода умягчения воды является необходимость очень точного дозирования реагентов.
В промышленности наиболее широко используемый метод умягчения воды включает ионообменных смол . Вода проходит через специальный фильтр, задерживающий ионы кальция Ca 2+ , магния Mg 2+ , железа Fe 2+ и марганца Mn 2+ . Эти «пойманные» ионы заменяются ионами калия K + , натрия Na + или водорода H + , выделяемыми в раствор.
Этот метод очень эффективен для умягчения воды.Достоинства этой методики - низкая стоимость реагентов и отсутствие сложных процедур, таких как осаждение и удаление осадка. Кстати, именно так умягчают воду в посудомоечной машине. Чтобы фильтр прослужил дольше, в посудомоечную машину наливают соль NaCl, которая замещает кальций и магний и насыщает фильтр ионами натрия.
В лаборатории часто используют другой процесс очистки воды, называемый обратным осмосом. Кроме того, этот метод иногда используют даже в домашних условиях.Вода проходит через мембрану, не пропускающую соли металлов. Важно отметить, что обратный осмос может принимать только воду, которая уже была предварительно обработана. Мембрана очень тонкая и нежная: она может быть повреждена высокими концентрациями солей. Обратный осмос - очень дорогой процесс очистки воды, но, в свою очередь, относительно быстрый и удобный.
Вот это интересно!
Какая вода лучше для вас: жесткая или мягкая?
Ответ прост: все хорошо в меру.Идеальный вариант для повседневного домашнего использования - это вода средней жесткости, содержащая некоторое количество солей кальция, магния, железа и марганца. Правильный баланс - всегда путь к гармонии.
Жесткая вода
Прежде всего, давайте разберемся, почему слишком жесткая вода - это проблема. Регулярное употребление жесткой водопроводной воды может способствовать образованию камней в почках и мочевом пузыре. Нет никаких других доказанных с медицинской точки зрения потенциальных опасностей для здоровья человека от его употребления. Использование жесткой воды для купания или мытья лица может часто вызывать раздражение кожи, особенно у детей.Кроме того, жесткая вода может вызывать некоторые неудобства в быту: соли кальция и магния, ответственные за жесткость воды, могут образовывать нерастворимые соединения с жирными кислотами, содержащимися в мыле. Это не только увеличивает расход мыла - в некоторых регионах из-за жесткости воды на умягчение воды уходит до 35% мыла, а затем только 65% - на гигиенические нужды. К сожалению, это также приводит к осаждению нерастворимых солей кальция и магния (стеаратов) в канализационных трубах, таким образом оседая там мыльную пену.Сегодня большинство моющих средств, в отличие от обычного мыла, содержат синтетические добавки, не вступающие в реакцию с солями жесткости. Таким образом, в настоящее время уходит «мыльная проблема» жесткой воды. К сожалению, возникла другая проблема: в жесткой воде нагревательные элементы стиральных и посудомоечных машин постепенно откладывают слой накипи и в конечном итоге перестают работать из-за этого. В домашнем хозяйстве жесткая вода доставляет некоторые неудобства, но в промышленных масштабах может создать настоящие неприятности. Даже слой известкового налета толщиной в миллиметр, осевший на внутренней части оборудования, резко снижает его эффективность теплообмена.Это не только увеличивает потребление электроэнергии для самого процесса, но также может повредить оборудование. Представьте себе огромный чайник, на дне которого постоянно образуется толстый слой известкового налета. Рано или поздно он выйдет из строя! А в промышленности они используют устройства и инструменты гораздо более сложные, чем чайник. Таким образом, как системы отопления, так и системы охлаждения требуют тщательного учета подаваемой воды.
Процессы с использованием химических веществ также требуют тщательной очистки воды. Например, окрашивание текстиля возможно только с использованием особо мягкой воды, потому что некоторые красители могут образовывать нерастворимые соединения с ионами кальция, магния, марганца и железа.В жесткой воде этот процесс с некоторыми красителями может быть очень сложным.
Мягкая вода
Теперь рассмотрим преимущества и недостатки использования мягкой воды.
Регулярное употребление мягкой воды может вызвать проблемы с зубами и костями, так как с питьевой водой мы обычно получаем значительное количество необходимых минералов. К счастью, проблема не такая уж и большая, поскольку потребность в кальции, магнии и марганце может быть удовлетворена за счет здорового питания.
В мягкой воде мыло пенится намного эффективнее, чем в жесткой воде. Однако для смывания моющего средства требуется значительно более мягкая вода, чем жесткая вода.
Кроме того, водопровод страдает от сверхмягкой воды: при нагревании вода с низкой концентрацией солей может постепенно растворять металлические конструкции. В химической промышленности часто используют не просто умягченную воду, а дистиллированную. Не только дистиллированная вода очень мягкая, но и не содержит многочисленных примесей, которые совершенно не влияют на жесткость воды, таких как сульфаты (SO 4 ) 2- , хлориды Cl - и натрий Na + . и ионы калия K + .
Дистиллированная вода: мягче не бывает
Дистиллированная вода - это вода, очищенная с помощью сложного процесса, называемого дистилляцией. Дистиллированная вода практически не содержит примесей. Интересно, что дистиллированная вода может быть переохлаждена ниже точки замерзания или перегрета выше точки кипения! Дистиллированная вода обычно используется в химических лабораториях и в химической промышленности, где чистота приготовленных растворов очень важна. Кроме того, дистиллированная вода используется в пищевой промышленности (для приготовления некоторых напитков), в автомобильной промышленности (для приготовления электролита для аккумуляторов), в медицине и цветной печати.
Есть также вода, дважды очищенная дистилляцией - это так называемая бидистиллированная вода. По составу она очень близка к химически чистой воде. Есть ли способ получить воду еще более чистой? Для получения такой воды необходимо использовать гамма-излучение с последующим барботированием инертным газом - аргоном Ar.
Действительно, обычная вода содержит множество невидимых глазу примесей: соли, частицы пыли, минералы и органические соединения. Полная противоположность обычной воде - это химически чистая вода, которая содержит только молекул воды H 2 O.
.Калькулятор жесткости воды - Расчет высокой точности
- Цель использования
- Оценить характеристики RO система с реминерализацией.
- Комментарий / запрос
- Пожалуйста, также добавьте другие минералы, такие как Na +, K + и расчет щелочности / pH.
Спасибо!
[1] 2020/03/10 02:49 Мужчина / 40-летний уровень / Учитель / Исследователь / Очень /
- Цель использования
- Попытка понять, как рассчитывается твердость для курс экологической инженерии
[2] 2019/10/11 02:43 Мужской / 20-летний уровень / Старшая школа / Университет / аспирант / Немного /
- Цель использования
- Сделать раствор
[3] 2019/07/15 11:16 Мужской / 20-летний уровень / Начальная школа / Младший школьник / Очень /
- Цель использования
- Расчет жесткости воды в помощь гражданину
[ 4] 2019/01/07 23:13 Мужской / 50-летний уровень / Другое / Очень /
- Цель использования
- Установка смягчителя воды....
[5] 2018/10/12 11: 01 Мужчина / 50 лет / Средняя школа / Университет / Аспирант / Полезно /
- Цель использования
- Разработка процесса
[6] 2018/06/16 02:25 Мужчина / 60 лет и старше / Инженер / Очень /
- Цель использования
- Для расчета жесткости колодезной воды на ферме на основе анализа минералов, проведенного на воде, чтобы помочь в определении буферных потребностей для гербицидов.
[7] 2017/03/02 05:40 Женский / 50-летний уровень / Другое / Очень /
- Цель использования
- Мг (мг / л) x4.118
- Комментарий / Запрос
- 4.118 означает
[8] 2017/03/01 18:27 Мужчины / Уровень 40 лет / Самостоятельно занятые / Очень /
- Цель использования
- очень помогите мне решение для жесткой воды. Много полезного ... много благодати
- Комментарий / запрос
- должен решить для обеспечения соответствия, если какое-либо использование является хорошим. Для решения проблемы потребуется много работы. Требуется в нормалях, не массах
[9] 2017/02/01 05:31 - / 60 лет и старше / Инженер / Очень /
- Назначение
- Быстрый расчет твердости.Работаю в очистке воды
[10] 24.05.2016 16:47 Мужчина / Уровень 20 / Инженер / Полезно /
Объяснение жесткости воды | Cropaia
Жесткость воды определяется как сумма ионов двухвалентных металлов в воде. Основными факторами жесткости воды являются кальций и магний. Дополнительные факторы, влияющие на жесткость воды, включают железо (Fe 2+ ), стронций (Sr 2+ ), цинк (Zn 2+ ), марганец (Mn 2+ ) и другие ионы. Однако их концентрации обычно значительно ниже, чем концентрации кальция и магния.
В большинстве случаев сумма кальция и магния в воде дает адекватный показатель жесткости.
КАК ВЛИЯНИЕ ЖЕСТКОСТИ ВОДЫ?
Кроме того, кальций и магний реагируют с мылом с образованием мыльной пены. Жесткая вода увеличивает расход мыла, так как мыло не пенится.
Имеет ли жесткость воды положительное влияние?
Да, в надлежащих концентрациях кальций и магний положительно влияют на здоровье человека, а также на растения.Оба они являются важными питательными веществами, и их недостаток может вызвать проблемы со здоровьем, поэтому питьевая вода и вода для орошения имеют определенный уровень жесткости.
ВРЕМЕННАЯ ЖЕСТКОСТЬ VS. ПОСТОЯННАЯ ТВЕРДОСТЬ
Существует два типа твердости - временная твердость и постоянная твердость.
Временная твердость - также называемая «карбонатной жесткостью». Этот тип жесткости относится к карбонатам и бикарбонатам кальция и магния в воде.Нагревание воды или реакция на нее с известью устраняют эту жесткость. CO2 выделяется в виде газа, и образуются осадки нерастворимого карбоната кальция и / или гидроксида магния.
Ca (HCO 3 ) 2 -> CaCO 3 ↓ + CO 2 ↑ + H 2 O.
Mg (HCO 3 ) 2 -> Mg (OH) 2 ↓ + 2CO 2 ↑
Постоянная твердость , также называемая «негарбонатной твердостью»; жесткость из-за присутствия сульфатов, хлоридов и нитратов кальция или магния.Например, сульфат кальция, хлорид магния и т. Д.
Удаление постоянной жесткости производится с помощью извести или извести с кальцинированной содой, в зависимости от химического состава воды.
Узнать больше
В КАКИХ ЕДИНИЦАХ ВЫРАЖАЕТСЯ ЖЕСТКОСТЬ?
Наиболее распространенной единицей измерения уровня жесткости воды является «мг / л как CaCO 3 ».
Концентрации кальция и магния выражены в эквиваленте CaCO 3 .
Следующую формулу можно использовать для расчета жесткости, если известны концентрации кальция и магния в воде:
Жесткость воды = 2,5Ca + 4,1Mg
Где кальций и магний измеряются в ppm (1ppm = 1 мг / Л).
Например, вода с 50 ppm Ca и 15 ppm магния будет иметь жесткость:
2,5 × 50 + 4,1 × 15 = 186,5 мг / л CaCO 3
Дополнительные единицы включают:
dGH - ' «Степени общей твердости» или «Немецкие градусы».
1 dGH = 17,484 мг / л CaCO 3
Зерна на галлон: 1 г / л = 17,1 мг / л CaCO 3
Французские градусы ⁰ f H:
1 Французские градусы = 10 мг / л CaCO 3
Классификация уровней жесткости воды:
Жесткость в мг / л CaCO3 | Уровень жесткости | Мягкий |
| 60–120 мг / л | Среднетвердый |
| 120–180 мг / л 900 | Жесткий |
| > 180 мг / л | Очень жесткий |
Жесткость воды
Есть разные типы жесткости воды:
| ● TH | – | Общая жесткость | |
| ● CH | – | Карбонатная жесткость | (временная жесткость) |
| ● NCH | – | Негарбонатная жесткость | (постоянная твердость) |
| ● PsH | – | Псевдотвердость |
Общая жесткость TH
Общая жесткость определяется как молярные концентрации всех мульти- -валентных катионов в воде (т.е.е. все, кроме одновалентных катионов):
| (1) | Общая жесткость TH = Σ многовалентных катионов |
На практике он часто используется как сумма двух наиболее важных пресноводных катионов, кальция и магния:
| (1а) | TH ≈ [Ca] + [Mg] |
Но это только приближение, хотя и хорошее. Правильная формула (согласно определению в 1 ):
| (1б) | TH = [Ca] + [Mg] + [Sr] + [Ba] + [Fe] + [Mn] + [Al] +… | »
Существует несколько шкал жесткости воды.Например, он может быть выражен в мэкв / л (единицы СИ), или в ppm CaCO 3 , или в немецких градусах жесткости:
.| (2а) | TH, мг-экв / л | = | 2 × ([Ca в мМ] + [Mg в мМ]) |
| (2б) | TH, частей на миллион | = | 100,1 × ([Ca в мМ] + [Mg в мМ]) |
| (2c) | TH дюйм ° d | = | 0.1339 × [Ca в мг / л] + 0,2307 × [Mg в мг / л] |
Правила разговора с другими устройствами приведены в таблице ниже. Общая жесткость TH используется для классификации водных растворов по четырем категориям жесткости воды.
Примечание. Если концентрации ионов Ca и Mg выражены как «ppm CaCO 3 », 1a также отображается в виде:
| (3) | Общая жесткость TH = жесткость по кальцию + жесткость по магнию |
Карбонатная жесткость CH
В то время как общая жесткость в 1 определяется содержанием катионов , существует также противоположная точка зрения, взятая из содержания анионов , которые делят общую жесткость на карбонатную жесткость CH (временную жесткость) и некарбонатную жесткость. NCH (постоянная твердость):
| (4) | Общая жесткость TH = CH + NCH |
Карбонатная жесткость напрямую зависит от щелочности:
| (5а) | CH в мэкв / л | = | [Алк в мэкв / л] |
| (5б) | CH, ° dH | = | 2.809 × [Алк в мэкв / л] |
Это означает, что в химии воды термины карбонатная жесткость и щелочность (т. Е. Щелочность M или общая щелочность) являются синонимами:
| (6) | Карбонатная жесткость CH = Щелочность |
Программа вычисляет TH и CH и отображает обе величины в таблицах результатов, как показано здесь.
Нкарбонатная жесткость NCH
И общая жесткость, и щелочность (т.е.е. карбонатная жесткость) - общие параметры анализа воды. Некарбонатная жесткость - согласно 4 - разница обоих величин:
| (7) | NCH = TH - CH |
Карбонатная жесткость называется временной жесткостью , потому что карбонаты Ca и Mg осаждаются в виде минералов при нагревании, тогда как Ca и Mg, связанные с сульфатами, хлоридами или нитратами, не осаждаются при нагревании (поэтому NCH называется постоянной твердостью ) .
Альтернативное толкование. Некарбонатная жесткость - это мера превышения сильных кислот над сильными основаниями:
| (8) | NCH = сильные кислоты - сильные основания |
При анализе воды сильных кислот проявляются в присутствии некарбонатных анионов, таких как сульфат, хлорид, нитрат. С другой стороны, сильных оснований обозначены одновалентными катионами (например,г. Na, K, аммоний). Таким образом, 8 преобразуется в
| (9) | NCH [мэкв / л] ≈ (2 × сульфат + хлорид + нитрат) - (Na + K + аммоний) |
, где измеренные концентрации следует вводить в ммоль / л.
Псевдотвердость PsH
Три величины, TH, CH и NCH, образуют стандартную терминологию жесткости воды почти во всех учебниках. Однако проблема возникает, если измеренная щелочность (т.е.е. CH) превышает общую жесткость: CH> TH. В этом частном случае 4 становится бессмысленным.
Чтобы решить эту проблему, терминология твердости должна быть расширена за счет дополнительной величины - псевдотвердости PsH (или «кажущейся твердости»). Он определяется как «отрицательный NCH» и выражается обратной цифрой 8 :
.| (10) | PsH = сильные основания - сильные кислоты = - NCH |
| (11) | PsH [мэкв / л] ≈ (Na + K + аммоний) - (2 × сульфат + хлорид + нитрат) |
Другими словами, PsH - это часть карбонатной жесткости, которая принадлежит одновалентным катионам (Na, K, аммоний).
Расширение общего отношения твердости
За счет дополнительного количества PsH мы можем расширить «стандартное уравнение твердости» (4):
| (12) | Жесткость воды: TH + PsH = CH + NCH |
Важно отметить, что PsH и NCH взаимоисключают в приведенной выше формуле: либо сильные основания перевешивают сильные кислоты (тогда NCH = 0), либо наоборот (тогда PsH = 0). Таким образом, 12 становится:
| (13а) | TH ≥ CH: | TH = CH + NCH | PsH = 0 |
| (13б) | TH | TH + PsH = CH | NCH = 0 | |
где 13a представляет собой «стандартное» соотношение твердости обычных учебников.
Пример: TH ≥ CH
Случай TH ≥ CH характерен практически для всех природных вод. Для иллюстрации возьмем пример воды C1.sol (кнопка Открыть ) со следующими параметрами:
| т | 10 ° С |
| pH | 7,34 |
| Алк | 2,50 мМ |
| Ca | 1,40 мМ |
| мг | 0.23 мМ |
| Na | 0,30 мМ |
| К | 0,05 мМ |
| Класс | 0,25 мМ |
| SO4 | 0,38 мМ |
| NO3 | 0,15 мМ |
Запустите пробу воды, нажав кнопку Start . Программа жалуется на ненулевой CBE, и мы устанавливаем точный баланс заряда, регулируя DIC (что снижает щелочность с 2.От 50 до 2,45 мэкв / л). Полученные значения твердости (как показано в столбце таблицы Output1 ):
| TH = 2,45 мэкв / л |
| CH = 3,26 мэкв / л |
Из разницы получаем: NCH = 0,81 мэкв / л. Псевдотвердости нет (PsH = 0). Общая жесткость определяется суммой Ca и Mg: TH = (2 × 1,40 + 2 × 0,23) мг-экв / л = 3,26 мг-экв / л - как показано на диаграмме выше.
Пример: TH
Мы используем тот же пример вода C1.sol и добавить 2 мМ NaOH (с кнопкой Reac ) .
Из-за добавления 2 мэкв / л сильного основания щелочность и, следовательно, CH увеличиваются на * 2 мэкв / л, а общая жесткость остается неизменной:
| CH = 4,45 мэкв / л |
| TH = 3,26 мэкв / л |
Здесь разница определяется псевдотвердостью: PsH = 1,19 мэкв / л. Нет NCH.
Значение PsH также можно рассчитать, подставив молярные концентрации входящей воды в 11 :
| (14) | PsH = (2.30 + 0,05) - (2 × 0,38 + 0,25 + 0,15) = 1,19 мэкв / л |
Обратите внимание, что Na также включает добавку 2 мМ NaOH : Na = (2,0 + 0,3) мэкв / л . Расчетное значение 14 явным образом показано как «Diff» на приведенной выше диаграмме.
Кальцитовые осадки. Из-за добавления 2 мМ NaOH вода становится перенасыщенной кальцитом. На нижнем графике показаны результаты при осаждении 1,37 мМ кальцита (столбец таблицы Output2 ):
| Канал | = | (4.45 - 2 × 1,37) мэкв / л | = | 1,71 мэкв / л |
| TH | = | (3,26 - 2 × 1,37) мэкв / л | = | 0,52 мэкв / л |
| PsH | = | CH - TH | = | 1,19 мг-экв / л (без изменений) |
Другие примеры
Далее мы добавляем один или два реагента в количестве 1 мМ в чистую воду (H 2 O). Результаты 20 расчетов приведены в таблице ниже; каждая строка относится к одному вычислению. Значения TH, CH, NCH и PsH приведены в последних столбцах.
Примечание: в случаях, когда CaCO 3 (кальцит) становится перенасыщенным (SI> 0), добавляется дополнительная строка для отображения результатов после осаждения кальцита.
Таблица преобразования
Жесткость воды выражается в разных единицах:
| (15а) | Немецкий язык: | 1 ° д | = | 10 мг / л CaO |
| (15б) | Французский диплом: | 1 ° f | = | 10 мг / л CaCO 3 |
| (15c) | Английский градус (° Кларк): | 1 ° в. Д. | = | 10 мг CaCO 3 в 0.7 л |
| (15д) | 1 часть на миллион CaCO 3 (норма США): | 1 ° а | = | 1 мг / л CaCO 3 |
Эти единицы связаны между собой простыми правилами преобразования:
| частей на миллион CaCO 3 | ° d | ° f | ° в. Д. | мэкв / л | ммоль / л | ||
| 1 часть на миллион CaCO 3 | = | 1 | 0.06 | 0,10 | 0,07 | 0,02 | 0,01 |
| 1 ° d | = | 17,8 | 1 | 1,78 | 1,25 | 0,357 | 0,178 |
| 1 ° | = | 10,0 | 0,56 | 1 | 0.70 | 0,2 | 0,1 |
| 1 ° в. Д. | = | 14,3 | 0,80 | 1,43 | 1 | 0,285 | 0,142 |
| 1 мэкв / л | = | 50,04 | 2,8 | 5 | 3,51 | 1 | 0.5 |
| 1 ммоль / л | = | 100.09 | 5,6 | 10 | 7,02 | 2 | 1 |
Коэффициенты пересчета в этой таблице вытекают непосредственно из молярных масс карбоната кальция и оксида кальция:
| (16а) | CaCO 3 : | 100.09 г / моль | или | 1 мг / л CaCO 3 | = | 0,010 мМ |
| (16б) | CaO: | 56,08 г / моль | или | 10 мг / л CaO | = | 0,178 мМ |
Примечания и сноски
[последнее изменение: 15 декабря 2020 г.]
.
Веб-страница не найдена на InspectApedia.com
.
Что делать, если ссылка на веб-страницу на InspectApedia.com приводит к ошибке страницы 404
Это так же просто, как ... ну, выбирая из 1, 2 или 3
- Воспользуйтесь окном поиска InspectAPedia в правом верхнем углу нашей веб-страницы, найдите нужный текст или информацию, а затем просмотрите ссылки, которые возвращает наша пользовательская поисковая система Google
- Отправьте нам электронное письмо напрямую с просьбой помочь в поиске информации, которую вы искали - просто воспользуйтесь ссылкой СВЯЗАТЬСЯ С НАМИ на любой из наших веб-страниц, включая эту, и мы ответим как можно скорее.
- Используйте кнопку НАЗАД вашего веб-браузера или стрелку (обычно в верхнем левом углу экрана браузера рядом с окном, показывающим URL-адрес страницы, на которой вы находитесь), чтобы вернуться к предыдущей статье, которую вы просматривали. Если вы хотите, вы также можете отправить нам электронное письмо с этим именем или URL-адресом веб-страницы и сообщить нам, что не сработало и какая информация вам нужна.
Если вы действительно хотите нам помочь, используйте в браузере кнопку НАЗАД, затем скопируйте URL-адрес веб-страницы, которую вы пытались загрузить, и используйте нашу ссылку КОНТАКТЫ (находится как вверху, так и внизу страницы), чтобы отправьте нам эту информацию по электронной почте, чтобы мы могли решить проблему.- Благодаря.
Приносим свои извинения за этот SNAFU и обещаем сделать все возможное, чтобы быстро ответить вам и исправить ошибку.
- Редактор, InspectApedia.com
Задайте вопрос или введите условия поиска в поле поиска InspectApedia чуть ниже.
Мы также предоставляем МАСТЕР-ИНДЕКС по этой теме, или вы можете попробовать верхнюю или нижнюю панель ПОИСКА как быстрый способ найти необходимую информацию.
Зеленые ссылки показывают, где вы находитесь. © Copyright 2017 InspectApedia.com, Все права защищены.
Издатель InspectApedia.com - Дэниел Фридман .жесткость воды
Это два типа жесткости воды. Временная и постоянная твердость. Этот калькулятор определяет постоянную общую жесткость. Для получения информации о временной жесткости воды щелкните здесь.
Общая постоянная жесткость воды рассчитывается по следующей формуле:
ОБЩАЯ ПОСТОЯННАЯ ЖЕСТКОСТЬ = КАЛЬЦИЕВАЯ ЖЕСТКОСТЬ + МАГНИЕВАЯ ЖЕСТКОСТЬ
Кальциевая и магниевая жесткость - это концентрация ионов кальция и магния, выраженная в эквиваленте карбоната кальция.Молярная масса CaCO 3 , Ca 2+ и Mg 2+ составляет соответственно 100,1 г / моль, 40,1 г / моль и 24,3 г / моль.
Соотношение молярных масс составляет:
Таким образом, общая постоянная жесткость воды, выраженная в эквиваленте CaCO 3 , может быть рассчитана по следующей формуле:
Следующий калькулятор рассчитывает и дает представление об общей жесткости воды.Поля, отмеченные *, обязательны.
Следующие значения используются для определения жесткости воды:
| Концентрация как CaCO3 | Показатель |
| от 0 до 60 мг / л | Мягкая вода |
| от 60 до 120 мг / л | Умеренно жесткая вода |
| от 120 до 180 мг / л | Жесткая вода |
| > 180 мг / л | Очень жесткая вода |
Другие калькуляторы
Предупреждение: Lenntech BV не может нести ответственность за ошибки в расчетах, самой программе или объяснениях.По вопросам или замечаниям обращайтесь к нам.
.
 Категории
Категории Корзина
Корзина Информация
Информация Хиты продаж
Хиты продаж