Как измерить кислотность воды
Кислотность воды и как она связана с жесткостью
Вода является основой функционирования организма, без нее невозможна работа внутренних органов человека. Поэтому человеку необходимо в день выпивать достаточное количество воды. Но важно не только количество, но и качество. Недостаток необходимых элементов делает ее бесполезной, а наличие вредных примесей и микроорганизмов опасной для здоровья. Тут необходим баланс, ведь в зависимости от концентрации одного компонента, другие могут менять свои свойства и трансформироваться.
Зная особенности жидкости, можно обезопасить себя. Проведение проверки и определение жесткости воды и ее кислотных показаний может выявить отклонение от норм. Так как качество воды является важным для человека, то своевременное выявление и устранение нарушений может предотвратить проблемы со здоровьем. К примеру, общая жесткость воды при отклонении от нормативных показателей может стать причиной многих нарушений. Самой распространенной является аллергическая реакция.
Повышение кислотности может вызывать нарушение кровообращения в организме и особенно это касается головного мозга, также кислота скапливается в организме, к примеру, в легких, и человек становится уязвим перед различными вирусами.
В отличие от жидкости с повышенной кислотностью, щелочные жидкости, наоборот, могут принести пользу для организма. К ним относятся различные минеральные воды. Туда входят ионы натрия, бор, фтор, алюминий и другие элементы, которые необходимы для правильной работы организма.
Вы можете осуществить такую экспертизу самостоятельно или же доверить ее в руки экспертов. В нашей независимой лаборатории «ЭкоТестЭкспресс» сделают все необходимые расчеты за вас и сэкономят ваше время и силы.
Как измерить кислотность воды в домашних условиях?
Узнать показатели кислотности воды не только в лаборатории, но и в домашних условиях. Сейчас не во всех случаях необходимо тщательное исследование с использованием нового и профессионального оборудования. Для простого осуществления контроля качества уже есть специальные способы проведения такого исследования. Конечно же они не могут дать максимально точный результат и точно не подойдут для осуществления постоянного контроля на предприятии.
Такое измерение кислотности воды в домашних условиях проводится при помощи различных химически активных веществ или же измерителей для кислотности воды. Перед началом необходимо изучить всю специфику такого исследования и проводить все в несколько этапов:
- В самом начале следует тщательно изучить и приобрести индикационные материалы. Качество таких материалов может сильно влиять на точность. К ним относятся лакмусовые бумажки, индикаторы кислотности и реагенты, а также и дополнительные материалы. Иногда материалы могут не подходить для каких-то конкретных проверок. Вы можете приобрести сразу комплект для измерений, где помимо этого содержится уже и шкала, по которой вы будете определять полученные результаты.
- Затем на лакмус наносятся дополнительные вещества, которые уже непосредственно вступают в реакцию с веществами в жидкости. И этот участок бумажки окрашивается в соответствующий цвет, исходя из силы произошедшей реакции. Лакмус, окрашенный в кислой среде, становится красным, а в щелочной цвет становится фиолетовым. В зависимости от индикатора если цвет не изменился или стал зеленым, то значит показатели в пределах нормы.
- Полученный цвет индикатора нужно сравнить с цветами в таблице. Обычно она или есть в комплекте или же ее можно распечатать самому. Эта шкала кислотности воды содержит градации цветов, которые покажут, является ли среда кислой, щелочной или же нейтральной. В зависимости от результатов уже следует выбирать способ нормализации состава жидкости.
- Также жесткость и кислотность воды являются взаимосвязанными и поэтому для определения кислотности можно использовать инструменты измерения жесткости.
- Еще определение кислотности ph можно проводить и при помощи специальных приборов. TDS-метр проверяет жидкость на электропроводность. Это выявляет наличие в воде кристаллов солей. Благодаря кристаллизации кальция и магния кислотность выявить довольно легко. Такой способ дает меньше погрешностей и может быть применен не только дома, но и при небольшом промышленном контроле качества воды.
Такие измерители могут быть двух видов: стационарные и портативные. Они способны не только определять кислотность, но и осуществлять измерение жесткости воды и понижать эти показатели. Но такие измерения не смогут быть точными, если в воду осуществляется добавление различных солей и примесей. Поэтому важно чтобы жидкость не содержала дополнительных добавок.
Но как было сказано ранее, такое домашнее измерение ph воды или же щелочности воды не всегда дают точные результаты. Иногда погрешности могут быть довольно большими, если не соблюдать все требования. Но даже при следовании инструкциям такие способы не могут выявить некоторые особенности или состав. Существуют сложные приборы, которые могут проверить качество и содержание.
Как производится очищение воды в случае повышенной кислотности?
Для проведения очистки стоит сперва провести точное и качественное исследование таких показателей как уровень жесткости воды и ее кислотность. Их можно исследовать как отдельно исходя из собственных нужд, так и комплексно. Они являются взаимосвязанными показателями и поэтому их удобно проверять вместе. Использование точного лабораторного оборудование и проведение экспертизы экспертами экологами может сберечь ваши силы и дать максимально точные результаты. Но в домашних условиях использование оборудования или лакмусовых бумажек тоже хороший вариант, так как в этом случае погрешность слишком мала для какого-то значительного влияния на результаты.
После получения результатов можно понять, каким способом необходимо понизить уровень кислотности воды. Анализ определяет завышен ли уровень ионов водорода и если он не соответствует нормам, то следует предпринять дальнейшие действия по улучшению качества жидкости. В таком случае следует следить не только за тем, чтобы уменьшить вредные для человека показатели, но и за тем, чтобы не был нарушен естественный баланс.
Существуют следующие способы, которые устраняют повышенную кислотность воды ph:
- Основным способом выступает кипячение жидкости. Таким образом концентрат водорода просто вываривается и показатели достигают нормы. Но еще при этом устраняется не только повышенная концентрация водорода, но и жесткость воды благодаря химическим реакциям. Но иногда в жидкости может наблюдаться повышенное содержание натриевых, калиевых и других соединений. При кипячении они не выпадают в осадок и тут следует использовать иной способ.
- Заморозка воды позволяет избавиться от лишних кристаллов и солей в жидкости. Ее можно осуществлять как искусственно, так и это может быть естественным природным явлением. В основном таким образом нормализуются показатели в различных водоемах и колодцах и при очистке воды в промышленных масштабах. Вода замораживается и кристаллизуется в особой последовательности, а ионы водорода и соли при этом остаются на поверхности, что позволяет их устранить.
-
Всевозможные фильтры осуществляют очистку воды и ее дистилляцию. В этом процессе ионы водорода и соли полностью фильтруются и удаляются из жидкости. Но в этом случае иногда необходимо дополнительно разбавлять ее водой, которая не прошла очистку, для стабилизации содержания различных веществ. Ведь баланс веществ тоже очень важен и лишенная некоторых микроэлементов вода не может в итоге восполнить их в организме человека.
- Ионизирующие приборы реагируют на уровень ph воды и устраняют тем самым кислотность. Реакция происходит на соли и кристаллы жесткости и впоследствии они устранятся. Чем сильнее реакция, тем большее очищение жидкости происходит.
Таким образом проверка воды не является сложной процедурой и доступна даже в домашних условиях. Благодаря этому контроль за качеством используемой воды может осуществляться постоянно. Это очень важно, ведь здоровье человека напрямую зависит от качества жидкости, которую он употребляет. При длительном употреблении такой воды могут возникнуть сердечно-сосудистые заболевания, различные заболевания скелета или даже образование опухолей. Нарушение кислотно-щелочного баланса также чревато постоянной усталостью и проблемами с кожей.
Устранение отклонения от норм также является доступным и зачастую не требует особых затрат от человека. Нередко их можно осуществить без специального оборудования, но специальные фильтры работают намного эффективнее и обеспечивают лучший результат.
Если же вы не хотите сами проводить измерения, то в исследовательской лаборатории «ЭкоТестЭкспресс» проведут все необходимые вам измерения и расчеты. Получив результаты, вы можете увидеть, соответствуют ли они различным государственным нормам и является ли такая жидкость пригодной для дальнейшего использования в бытовых нуждах или в пищу.
как проверить pH в домашних условиях прибором для измерения кислотности и подручными средствами?

Качество питьевой воды напрямую зависит от ее кислотности pH. Данная характеристика раствора считается одной из важных. В зависимости от величины параметра определяют виды химических процессов, происходящих в жидкости, а также оценивают пригодность употребления воды и ее возможное использование в быту или народном хозяйстве.
Зачем измеряется pH воды?
Аббревиатура pH переводится как pondus Hydrogenium. Дословный перевод фразы – «вес водорода». Таким образом, для определения качества воды необходимо подсчитать, сколько ионов водорода содержится в ней. В случае нейтрального раствора их количество будет совпадать с количеством гидроксильных ионов. Поэтому стремление показателя pH к отметке выше 7 показывает, что раствор основной. В случае если параметр движется к нулю, вода определяется как кислая. Нейтральная жидкость обладает показателем pH=7.
Резкие изменения кислотности демонстрируют загрязнение или ухудшение характеристик состава воды, в этом случае параметр должен подвергаться регулярному контролю. Особенно важно уделять внимание показателю pH, если речь идет о питьевой воде.
У параметра также есть технологическое значение. С его помощью подбирают материал для труб систем водоснабжения или других конструкций, так как кислотность позволяет определить предрасположенность воды к загрязнению, вследствие чего может возникнуть коррозия. Важно, чтобы показатель лежал в определенном диапазоне для всей жидкости, поступающей в жилые дома или на промышленные объекты по трубопроводам. Если pH меньше 7, это может привести к формированию ржавчины на поверхности труб и их быстрому износу.
Также высокая кислотность приводит к образованию различных отложений в трубах, формирующих пробку.
Основные способы определения
Измерить pH раствора удастся с помощью разных методик. Специалисты используют различные индикаторы, тестовые полоски, лакмус. Последний вариант считается наиболее распространенным ввиду простоты и небольшой цены. Также для определения кислотности используют электромеханические методики. Стоит рассмотреть подробнее самые востребованные способы проверки.
Лакмусовая бумажка
Наиболее доступный вариант измерения уровня pH в бутылке, аквариуме или другой емкости. Подходит для использования в домашних условиях и считается подручным средством измерения кислотности раствора. В данном случае лакмусовый краситель выступает в роли индикатора кислот, посредством которого удается определить величину показателя pH и характеристики жидкости.
Лакмус является красителем растительного происхождения, который меняет цвет на синий в щелочной среде и на красный – в кислой. Чтобы проверить уровень кислотности, необходимо опустить бумажку в пробирку с водой. После взаимодействия бумаги с раствором первая поменяет цвет. Существует два варианта развития событий.
- Бумага окрашивается в синий цвет. Показатель pH>7.
- Бумага приобретает красный оттенок. Показатель pH
Минус этого способа в том, что точно определить параметр кислотности не получится.
Специальный прибор
Более достоверный способ узнать уровень кислотности воды – воспользоваться измерительным прибором. Большинство устройств для измерения pH работают по принципу потенциометрии. PH-метры отлично подходят для определения показателя кислотности в насыщенных растворах. Так, с помощью специального устройства можно узнать величину ионов водорода в:
- воде из водоемов;
- водопроводной;
- минеральной;
- аквариумной.
Для проведения измерений жидкость набирают в пробирку, куда затем опускают стеклянный электрод – тестер. В процессе формируется напряжение гальванического типа между внутренней и наружной частями электрода. На показатель напряжения измерителя влияет кислотная среда. Точность измерений электронного анализатора высокая, погрешность не превышает 0,01 единиц pH.
Другие
Как уже было отмечено, лакмусовая бумага не дает высокой точности измерений. Кроме того, такой способ позволит только определить тип среды. На практике чаще используют специальные тест-полоски, что прописаны смесями, в каждой из которых содержится универсальный индикатор, который позволяет определить величину ионов водорода в воде или другой жидкости.
Кислотность определяют следующим образом:
- полоску опускают в раствор, подлежащий тестированию;
- она окрашивается в определенный цвет, что зависит от pH жидкости, в которой находится;
- посредством цветовой шкалы определяют значение кислотности.
Цвета красно-оранжевого спектра демонстрируют кислую среду. Оттенки от зеленого до синего говорят о среде щелочной. Каждый интервал показывает точность измерений в 1 или 2 единицы. Не так давно стали выпускать полоски, точность которых составляет 0,3 единицы.
Такой способ определения pH считается наиболее востребованным и универсальным.
Каким должен быть показатель?
Показатель кислотности обычной воды, которая встречается в природе, лежит в пределах от 6,5 до 8,5. Чистая вода, избавленная от различных примесей и загрязнений, абсолютно нейтральна. Однако при взаимодействии с воздухом такая жидкость реагирует на углекислый газ, и среда становится более кислой.
Воды с абсолютно нейтральным pH в природе нет, так как источник жидкости в любом случае содержит какие-либо соединения. Например, родниковая вода, которую многие считают очень мягкой, имеет показатель меньше 7, а у речных pH=8.
Примечательно, что природная вода – это разбавленный раствор, показатель кислотности которого постоянно подвергается изменениям. Окончательная величина параметра зависит от того, какой тип веществ растворяется в жидкости. Нормы pH регулирует ГОСТ 32169-2013, в котором прописаны стандартные значения кислотности для питьевой, технической и другой жидкости, используемой в быту.
Различные соединения, которые находятся в воде, способны дать начало определенным процессам. Поэтому многие компании, предоставляющие услуги водоснабжения, тщательно отслеживают показатель кислотности и контролируют кислотно-щелочной баланс с применением специальных технологий очистки.
Согласно рекомендациям ВОЗ параметр pH для питьевой воды должен лежать в пределах от 6,5 до 9,5. В этом случае жидкость сохраняет баланс между вкусом, запахом и прозрачностью. Кислотность газированного раствора зависит от типа солей и их концентрации.
Уметь определять показатель pH важно, чтобы не только обеспечить жителей регионов качественной водой, но также подобрать подходящие материалы для обустройства трубопровода. Сегодня подсчитать количество ионов водорода в любом растворе можно разными способами, при желании провести проверку характеристик жидкости можно даже в домашних условиях.
Для этого достаточно воспользоваться одним из наиболее распространенных способов определения pH: приобрести тестовую полоску и сравнить полученный результат с цветовой шкалой.
Что такое pН воды и почему важно его знать
Что такое pН воды и почему важно его знать
Что такое pН воды и почему важно его знать
Уровень активности ионов водорода в воде является одним из важнейших факторов, влияющих на оценку качества жидкости. Именно от данного критерия зависит уровень кислотно-щелочного баланса и направленность биохимических реакций, которые будут происходить в организме после употребления этой жидкости. В данной статье мы подробнее остановимся на вопросе, что такое pН воды, каким образом его определяют, а также же как повысить или понизить pН воды.
Из этой статьи вы узнаете:
-
Что такое pН воды
-
Какова норма pН воды
-
Чем грозит низкий уровень pH воды
-
Как измерить pН воды
Что такое pН воды
Показатель pH является единицей активности иона водорода, которая равна обратному логарифму активности водородных ионов. Так, например, вода, pH которой составляет 7, обладает 10–7 моль на один литр ионов водорода. Следовательно, жидкость с pH равном 6 – 10–6 моль на один литр. Шкала показателей pH при этом варьирует в диапазоне от 0 до 14. Если pH воды менее 7, то она является кислой, а если более 7 – тогда щелочной. Норма pH для поверхностных водных систем составляет 6,5–8,5, для подземных – 6–8,5.
Показатель pH воды равняется 7 при 25 °С, но при взаимодействии с диоксидом углерода в атмосфере данное значение будет составлять 5,2. Уровень pH тесно связан с атмосферным газом и температурой, поэтому воду следует проверить в самые короткие сроки. pH воды не сможет дать полной характеристики и повода для ограничения подачи воды.
Когда в воде растворяются различные химические вещества, то данный баланс подлежит изменению, что, в свою очередь, провоцирует изменение показателя pH. Если в воду добавить кислоту, концентрация ионов водорода возрастает, и концентрация гидроксид-ионов, в свою очередь, понижается. Если в жидкость добавить щелочь, тогда концентрация гидроксид-ионов возрастает, а содержание ионов водорода понижается.
Статьи, рекомендуемые к прочтению:
Уровень pН воды показывает уровень кислотности или щелочности среды, а кислотность и щелочность характеризуется количественным содержанием в воде элементов, нейтрализующих щелочь и кислоту. Так, например, температура отражает уровень нагрева вещества, но не количественный показатель тепла. Если мы коснемся воды рукой, то мы определим, теплая она или холодная, но мы не сможем сказать, какое количество тепла в ней содержится (другими словами, сколько потребуется времени для того, чтобы вода остыла).
Показатель pH – один из основных качественных характеристик воды. Он отражает кислотно-щелочной баланс и определяет, каким образом будут происходить те или иные биологические и химические процессы. Величиной pH воды определяется скорость протекания той или иной химической реакции, уровень коррозионной агрессивности жидкости, степень токсичности загрязняющего вещества и многие другие факторы. Более того, кислотно-щелочной баланс среды организма определяет наше состояние здоровья, настроение и самочувствие.
Различают следующие группы воды, в зависимости от показателя pH:
|
Тип воды |
Величина рН |
|
Сильнокислые воды |
<3 |
|
Кислые воды |
3–5 |
|
Слабокислые воды |
5–6,5 |
|
Нейтральные воды |
6,5–7,5 |
|
Слабощелочные воды |
7,5–8,5 |
|
Щелочные воды |
8,5–9,5 |
|
Сильнощелочные воды |
>9,5 |
Контролировать уровень pН воды необходимо на каждом этапе очистки жидкости, поскольку смещение баланса может негативно отразиться на вкусовых качествах, запахе и оттенке воды, а также снизить эффективность ее очистки.
Каков нормальный pН воды
Из-за стремительного темпа современной жизни, неправильного питания, нарушения пищевого и питьевого режимов уровень pН в организме человека падает. Так, кислотно-щелочной баланс смещается в сторону повышенной кислотности (pН до значения 7 подразумевает кислую среду, и до 14 – щелочную, соответственно, чем ниже данный уровень, тем выше кислотность), что может привести к серьезным заболеваниям. Решать эту проблему можно с помощью ежедневного употребления минеральной воды с оптимальным уровнем активности ионов водорода. Именно поэтому важно знать, какая величина pН является нормой для воды, которую вы регулярно употребляете в пищу.
Итак, какой должен быть pН воды? Профессионалы утверждают, что эта величина должна ориентировочно соответствовать нормальному показателю pН крови человека (7,5). Именно поэтому для питьевой воды норму pН рассчитывают от 7 до 7,5. Благодаря чистой питьевой воде с нормальным показателем активности ионов водорода улучшаются обменные процессы в организме, увеличивается общая продолжительность жизни и оптимизируется обмен кислорода. И наоборот, из-за сладких, газированных и содержащих красители напитков уменьшается pН человеческой крови, что можно сразу заметить по неприятной сухости во рту.
Поэтому лучше всего отдавать предпочтение воде с «правильным» показателем pН. Вы всегда сможете найти эту информацию на этикетке любой бутылки. Никакой фильтр с наполнителями и абсорбентами не сможет заменить настоящую природную воду с оптимальным уровнем pН. Некоторые пытаются понизить кислотность воды pН и придать жидкости полезные свойства, добавляя лимонный или огуречный сок, тем не менее это далеко не всегда оказывает должный эффект. Еще один известный способ изменения pН воды – это электролиз, который позволяет получить в двух емкостях щелочную и кислую воду. Щелочная вода с высоким pН считается «живой», ее используют для лечения, а кислая – «мертвой», которую чаще всего используют для умывания.
Тем не менее такие способы не подойдут для ежедневного использования. В этой ситуации остается только одно рациональное решение – отдать предпочтение слабоминеральной природной воде с необходимым для здоровья уровнем кислотности.
Измерение pН воды
Не стоит забывать о том, что человеческий организм на целых 70 % состоит из воды! Продукты обмена веществ в клетках представляют собой кислоты, в то время как основная масса внутренних жидкостей организма, за исключением желудочной кислоты, слабощелочные. Особое значение при этом имеют показатели крови. Организм человека нормально функционирует, если его кровь слабощелочная, и величина ее pН составляет от 7,35 до 7,45.
В том случае, когда в кровь и межклеточную жидкость попадает большое количество кислот, происходит нарушение кислотно-щелочного баланса. Даже небольшое отклонение уровня pН от данных показателей (от 7,35 до 7,45) может привести к серьезному нарушению здоровья. Если продолжается процесс повышения кислотности крови и дальнейшее понижение значения pН до 6,95, то наступает кома и возникает настоящий риск для жизни человека! Именно по этой причине необходимо отслеживать величину pН питьевой воды, которая является одной из важнейших показателей ее качества!
- Лакмусовая бумага.
Уровень pН воды вы сможете определить самостоятельно, в домашних условиях. В качестве прибора для измерения pН воды вы можете использовать лакмусовую (индикаторную) бумагу, которая меняет свой оттенок при кратковременном погружении в изучаемую среду. Так, при погружении в кислотную среду лакмусовая полоска приобретает красный оттенок, а в щелочную – синий. Далее следует сравнить получившийся цвет с цветной шкалой, в которой для каждого оттенка соответствует конкретный уровень pН, чтобы определить данный показатель у исследуемой жидкости. Данный метод определения pН является самым простым и дешевым.
Для наиболее точного определения уровня pН используют pН-метр для воды. Данный прибор для определения pН воды более дорогостоящий, чем лакмусовая бумага, тем не менее он определяет уровень pН жидкости в точности до сотых!
РН-метры для воды бывают бытовыми (портативными) и лабораторными. Чаще всего используют первый вариант, мы остановимся на них подробнее. Они различаются:
-
Степенью защиты от воды.
-
Наличием (или отсутствием) автоматической калибровки.
-
Точностью результатов.
Последний параметр определяется количеством калибруемых точек (1 или 2). Точками называют буферные растворы, с помощью которых и производят калибровку РН-метра. Рекомендуем приобрести прибор с автоматической калибровкой.
- Самодельные тест-полоски.
Существуют специальные тест-полоски, определяющие уровень pН-среды. Такие полоски очень удобны в использовании. Их упаковка оснащена шкалой, с помощью которой определяют концентрацию водородных ионов. Но такие тест-полоски не так часто появляются в продаже, при этом они довольно дорогостоящие.
При всех своих преимуществах pН-метры для воды также отличаются сравнительно высокой ценой.
Вы можете воспользоваться самодельными тест-полосками, чтобы определить pН воды.
Существуют различные вещества, которые меняют свой цвет в зависимости от содержания водородных ионов в жидкости. Например, чай вместо коричневого оттенка приобретает желтый, если в него добавить ломтик лимона.
Таким же образом меняют свой цвет, в зависимости от содержания водородных ионов, вишневый, смородинный соки и т. д. В природе существует огромное количество таких органических индикаторов. И на основе таких индикаторов создают самодельные тест-полоски, которые позволяют определить pН воды.
Мы воспользуемся веществом, входящим в состав красной цветной капусты. Данный овощ содержит пигмент anthocyanin, относящийся к категории флавоноидов. Именно он отвечает за оттенок сока капусты и меняет его, в зависимости от уровня кислотности.
Антоцианы в кислой среде приобретают красный оттенок, а в щелочной – синий, в фиолетовый они окрашиваются, находясь в нейтральной среде. Аналогичными свойствами обладает и пигмент свеклы.
Для проведения эксперимента вам потребуется половина качана красной цветной капусты среднего размера, который следует мелко нарезать. Затем нарезанную капусту необходимо положить в емкость и залить литром воды. Затем вскипятите воду и оставьте данное зелье вариться в течение 20–30 минут.
За это время часть жидкости испарится, и вы получите отвар насыщенного фиолетового оттенка. Затем остудите зелье и приготовьте основу для теста.
Идеальным вариантом в этом случае послужит белая принтерная бумага, которая не будет вносить погрешности в цвет жидкости. Также ее преимущество заключается в том, что она хорошо впитывает отвар индикатора. Бумага должна быть нарезана полосками ориентировочно 1×5 см.
Перед тем как вы будете определять уровень pН воды, необходимо пропитать тест-полоски индикаторным раствором. Для этого процедите остывший отвар сквозь марлю и опустите в него бумагу. Следите за тем, чтобы тест-полоски пропитались равномерно. Пропитывать бумагу следует в течение 10 минут. В результате бумага должна приобрести бледно-сиреневый оттенок.
Далее просушите тест-полоски, разложив их на чистой бумаге или развесив на бельевой веревке.
Когда бумага, пропитанная отваром, высохнет, вы можете приступать к определению уровня pН воды. Затем сложите тест-полоски в коробку или полиэтиленовый пакетик, чтобы уберечь их от влаги.
Использовать данный метод определения уровня pН очень легко. Возьмите пипетку и капните одну-две капли испытуемого раствора на тест-полоску. Подождите одну-две минуты, чтобы индикатор вступил в реакцию с бумагой. В зависимости от показателя pН воды бумага приобретет определенный оттенок, который следует сравнить с цветной шкалой, имеющей следующий вид:
Для калибровки цветной шкалы используются вещества, которые в первоначальном виде имеют постоянный pH среды. Ниже расположена подробная таблица этих элементов:|
Некоторые значения pН |
|
|
Вещество |
pH |
|
Лимонный сок (5 % р-р лимонной кислоты) |
2,0±0,3 |
|
Пищевой уксус |
2,4 |
|
Кока-кола |
3,0±0,3 |
|
Яблочный сок |
3,0 |
|
Пиво |
4,5 |
|
Кофе |
5,0 |
|
Шампунь |
5,5 |
|
Чай |
5,5 |
|
Слюна |
6,35–6,85 |
|
Молоко |
6,6–6,9 |
|
Чистая вода |
7,0 |
|
Морская вода |
8,0 |
|
Мыло (жировое) для рук |
9,0–10,0 |
|
Нашатырный спирт |
11,5 |
|
Отбеливатель (хлорная известь) |
12,5 |
|
Концентрированные растворы щелочей |
>13 |
Данная таблица вам поможет в том случае, если вы захотите провести эксперимент, используя какой-либо другой индикатор (например, свекольный отвар, сок черной смородины или шелковицы).
Если полученный результат не внушает вам доверия, или вы по каким-то причинам не смогли решить проблему несбалансированного pН воды, тогда обратитесь к профессионалам.
На российском рынке присутствует немало компаний, которые занимаются разработкой систем водоочистки. Самостоятельно, без помощи профессионала, выбрать тот или иной вид фильтра для очистки воды довольно сложно. И уж тем более не стоит пытаться смонтировать систему водоочистки самостоятельно, даже если вы прочитали несколько статей в Интернете и вам кажется, что вы во всем разобрались.
Наша компания Biokit предлагает широкий выбор систем обратного осмоса, фильтры для воды и другое оборудование, способное вернуть воде из-под крана ее естественные характеристики.
Специалисты нашей компании готовы помочь вам:
-
подключить систему фильтрации самостоятельно;
-
разобраться с процессом выбора фильтров для воды;
-
подобрать сменные материалы;
-
устранить неполадки или решить проблемы с привлечением специалистов-монтажников;
-
найти ответы на интересующие вопросы в телефонном режиме.
Доверьте очистку воды системам от Biokit – пусть ваша семья будет здоровой!
Как определить уровень рН
Индикаторная лакмусовая бумага обеспечивает быстрый и экономичный способ измерения рН (водородный показатель) любой необходимой жидкости и смесей жидкостей (моча, слюна, кал, сперма, кислотность влагалища, грудное молоко, растворы, вода, напитки и т.п.).
Лакмусовая бумага - необходима как в семье, так и у специалиста, проводящего исследование пациента, применима в химических лабораториях, используется для исследовательской деятельности.
В химии есть вещества, обладающие способностью менять свою окраску в присутствии кислот и щелочей. Эти вещества называются индикаторами и применяются для определения реакционной среды. Среда может быть кислой, щелочной и нейтральной. Этими веществами пропитывают фильтровальную бумагу.
Лакмус - это красящее вещество, добываемое из некоторых видов лишайника. Состав его сложен. Лакмус - слабая кислота, которой пропитывают бумагу.
Как пользоваться индикаторной бумагой:
Необходимо окунуть узкую полоску бумаги в необходимый раствор на две-три секунды. Сравнить с прилагаемой цветовой шкалой и вычислить значения.
В нейтральном растворе при 25°С рН = 7. В кислых растворах рН 7, чем больше щёлочность раствора, тем его значение больше. Вывод: чем меньше рН, тем больше концентрация ионов Н+, т. е. выше кислотность среды, и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щёлочность среды.
Параметры индикаторной бумаги: измерение pH от 1 до 14. Индикаторная бумага может иметь вид полосок, рулонов, в коробках, в тубусах, пеналах, отрывная. Универсальной индикаторной бумагой пользуются только для приближённого определения значений рН в широких пределах с точностью около одной единицы рН или десятой доли.
ПШ - МЕТР - НУЖЕН ЛИ ОН?
Чтобы точно идентифицировать значение этого показателя в рутинных методах пользуются рН-метром. Использование индикаторов для определения точного значения не практикуется из-за субъективного определения цвета или невысокой точности самого индикатора. Однако, преимуществом индикаторов является их дешевизна, наглядность анализа, быстрота.
Пш метры имеют различные характеристики, исходя из которых формируется его стоимость, а именно диапазон измерения PH: 0.00 - 14.00, рабочая температура, цена деления: 0,1 pH, точность: 0,1 pH . Стоимость колеблется от 15 до 100 дол.
Для мыловарения и кремоварения, в принципе подойдет самый дешевый. Он имеет следующие характеристики: диапазон измерения PH: 0.00 - 14.00, рабочая температура: 0 - 50°С, цена деления: 0,1 pH, точность: 0,1 pH . ПШ метр должен быть обязательно откалиброван.
Если ПШ метр неоткалиброван, показывает неверные значения, то нужно его откалибровать.
Пример калибровки ph метра 009. Впрочем и другие модели калибруются по этому же принципу !
Что нужно для калибровки? Собственно пш метр, отвертка шлицевая (идет в комплекте), калибровочный раствор и конечно же, прямые руки, куда же без них - без них необходится ни одно дело. Я считаю что бюджетный ph метр 009 достаточно калибровать по одной точке, имея раствор ph 4.00, либо ph 6.8. Раствор должен иметь комнатную температуру! Если он хранится в холодильнике, заранее достаньте его, хорошенько взболтайте его непосредственно перед самой калибровкой.
Включенный пш метр поместите в калибровочный раствор. Выждете минуту. На обратной стороне пш метра есть винт, его надо крутить по часовой стрелке или против, в зависимости от показателя на дисплее. Вы должны сопоставить значения на дисплее с ph вашего раствора! Вот собственно и весь технологический процесс!
КАК ПОЛЬЗОВАТЬСЯ ПШ МЕТРОМ
Обычно к прибору прилагается инструкция.
Ниже приведен пример инструкции Миниатюрного рН-метра-тестер pH-PAL
- снять защитный колпачок в нижней части корпуса;
- включить прибор, сдвинув верхний переключатель вправо;
- погрузить прибор в исследуемый раствор до рифленой метки;
- помешать энергично в течение 5-6 секунд. Произвести считывание показаний после их стабилизации;
- если электрод был сухим, выждать несколько дольше, что позволит прибору осуществить термокомпенсацию;
- после каждого измерения тщательно промывать электрод дистиллированной водой;
- после окончания измерений выключить прибор и надеть защитный колпачок.
НОРМЫ PH
Растворы и жидкости в отношении их кислотности считаются:
- нейтральными при рН = 7
- кислыми при pH 7
Кислотность мочи
Если уровень рН мочи колеблется в пределах 6,0 - 6,4 по утрам и 6,4 - 7,0 по вечерам, то организм функционирует нормально. Наиболее оптимальный уровень - слегка кислый, в пределах 6,4 - 6,5. Значение рН мочи ниже 5,0 говорит о ее резкой закисленности, выше 7,5 - о ее резко щелочной реакции.
Реакция мочи определяет возможность образования камней: уратных - в кислой, оксалатных - в нейтрально-кислой, фосфатных - в более щелочной среде. Так, например камни мочевой кислоты фактически никогда не встречаются при рН мочи более 5,5, а фосфатные камни никогда не образуются, если моча не щелочная. Лучшее время для определения уровня рН - за 1 час до или спустя 2 часа после еды.
Проверяйте уровень рН два раза в неделю 2-3 раза в день.
С помощью Индикаторной лакмусовой бумаги рН-теста можно легко, быстро и точно проследить за ответной реакцией мочи на изменение типа питания, применение лекарственных средств или БАД. Положительная динамика рН может служить критерием правильности выбранной диеты или лечения.
Кислотность мочи сильно изменяется в зависимости от принимаемой пищи, например, приём растительной пищи повышает щелочную реакцию мочи. Кислотность мочи повышается, если в рационе человека преобладает мясная пища, богатая белками.
Увеличивает кислотность мочи тяжелая физическая работа.
Повышение кислотности мочи отмечается при повышенной кислотности желудка. Пониженная кислотность желудочного сока не влияет на кислотность мочи.
Кислотность мочи изменяется при многих заболевания или состояниях организма, поэтому определение ее кислотности является важным диагностическим фактором.
Кислотность слюны:
Кислотность слюны зависит от скорости слюноотделения. Обычно кислотность смешанной слюны человека равна 6,8–7,4 pH, но при большой скорости слюноотделения достигает 7,8 pH. Кислотность слюны околоушных желёз равна 5,81 pH, подчелюстных — 6,39 pH. У детей в среднем кислотность смешанной слюны равна 7,32 pH.
Оптимальное измерение с 10 до 12 часов. Измерять ее лучше натощак, за два часа до или два часа после приема пищи. Слюноотделение снижается в вечерние часы и ночью.
Для увеличения слюноотделения, с целью повышения pH показателя слюны, хорошо если на тарелке будет лежать кусочек лимона, он даже при зрительном восприятии повышает слюноотделение. Пища должна выглядеть аппетитно, подаваться на красивой посуде, аппетитно оформленной зеленью и/или/ овощами, должна, что называется радовать глаз! Текут не только слюнки, но и соки в организме, готовящиеся к процессу переваривания пищи. Это психическая фаза пищеварительной секреции.
Кислые гастроэзофагеальные и фаринголарингеальные рефлюксы, достигающие полости рта, играют ведущую роль в возникновении патологии полости рта. В результате попадания соляной кислоты происходит снижение кислотности смешанной слюны ниже 7,0 рН. Слюна, в норме обладающая щелочными свойствами, при низком рН, особенно при значениях 6,2–6,0, приводит к очаговой деминерализации эмали зубов с появлением эрозий твердых тканей зубов и образованием в них полостей — кариеса. Увеличивается количество слизи на слизистой оболочке, десны становятся отечными и воспаленными.
При понижении кислотности в ротовой полости, снижается кислотность зубного налета, что вызывает развитие кариеса.
Находящиеся во рту бактерии «расцветают» при отсутствии воздуха. Слюна же, богатая кислородом, активно препятствует их размножению. Неприятный запах изо рта появляется, когда приток слюны замедляется, к примеру, во сне. Волнение, голод, произнесение длинного монолога, дыхание через рот (к примеру, при насморке), стресс – сушат ротовую полость, приводя к понижению pH слюны. Уменьшение притока слюны неизбежно происходит с возрастом.
Можно подключить слабощелочное полоскание рта водой с добавлением соды и так же приема ее внутрь между едой, предложенный профессором Огуловым А.Т. – слабощелочного pH 7,4-8. Полоскание рта содовой водой имеет место при различных воспалительных заболеваниях десен и зубов и при общем закислении организма.
Установить нужный pH воды для полоскания или приема внутрь можно при помощи лакмусовой индикаторной бумаги. Рецептов с нужными пропорциями быть не может, т.к. вода в каждом регионе своя, имеющая свой pH. Потому необходимо иметь под рукой индикаторную бумагу.
Кислотность влагалища
Нормальная кислотность влагалища женщины колеблется от 3,8 до 4,4 pH и в среднем составляет 4,0–4,2 pH.
Кислотность влагалища при различных заболеваниях:
- цитолитический вагиноз: кислотность меньше 4,0 рН
- нормальная микрофлора: кислотность от 4,0 до 4,5 pН
- кандидозный вагинит: кислотность от 4,0 до 4,5 pН
- трихомонадный кольпит: кислотность от 5,0 до 6,0 pH
- бактериальный вагиноз: кислотность больше 4,5 pH
- атрофический вагинит: кислотность больше 6,0 pH
- аэробный вагинит: кислотность больше 6,5 pH
За поддержание кислотной среды и подавление роста условно-патогенных микроорганизмов во влагалище отвечают лактобактерии (лактобациллы) и, в меньшей степени, другие представители нормальной микрофлоры. При терапии многих гинекологических заболеваний на первый план выходит восстановление популяции лактобацилл и нормальной кислотности.
Кислотность спермы
Нормальный уровень кислотности спермы находится в пределах от 7,2 до 8,0 рН. Отклонения от этих значений, само по себе, не рассматривается как патология. В то же время в совокупности с другими отклонениями может свидетельствовать о наличии заболевания.
Увеличение уровня рН спермы происходит при инфекционном процессе. Резко щелочная реакция спермы (кислотность примерно 9,0–10,0 рН) свидетельствует о патологии предстательной железы.
При закупорке выводных протоков обоих семенных пузырьков отмечается кислая реакция спермы (кислотность 6,0–6,8 рН). Оплодотворяющая способность такой спермы снижена. В кислой среде сперматозоиды теряют подвижность и погибают. Если кислотность семенной жидкости становится меньше 6,0 рН, сперматозоиды полностью теряют подвижность и погибают.
Кислотность слез в норме — от 7,3 до 7,5 pH.
Кислотность в желудке.
- Минимальная теоретически возможная кислотность в желудке 0,86 рН.
- Максимальная теоретически возможная кислотность в желудке 8,3 рН.
- Нормальная кислотность в просвете тела желудка натощак 1,5–2,0 рН.
- Кислотность на поверхности эпителиального слоя, обращённого в просвет желудка 1,5–2,0 рН.
- Кислотность в глубине эпителиального слоя желудка около 7,0 рН. Нормальная кислотность в антруме желудка 1,3–7,4 рН.
Причиной многих болезней органов пищеварительного тракта является дисбаланс процессов кислотопродукции и кислотонейтрализации. Длительная гиперсекреции соляной кислоты или недостаточность кислотонейтрализации, и, как следствие, повышенная кислотность в желудке и/или двенадцатиперстной кишке, вызывает так называемые кислотозависимые заболевания. В настоящее время к ним относят: пептическую язву желудка и двенадцатиперстной кишки,гастроэзофагеальную рефлюксную болезнь (ГЭРБ), эрозивно-язвенные поражения желудка и двенадцатиперстной кишки на фоне приема аспирина или нестероидных противовоспалительных препаратов (НПВП), синдром Золлингера-Эллисона, гастриты и гастродуодениты с повышенной кислотностью и другие.
Пониженная кислотность наблюдается при анацидном или гипоацидном гастрите или гастродуодените, а также при раке желудка. Гастрит (гастродуоденит) называется анацидным или гастритом (гастродуоденитом) с пониженной кислотностью, если кислотность в теле желудка составляет примерно 5 или больше единиц pH. Причиной пониженной кислотности часто бывает атрофия париетальных клеток в слизистой оболочке или нарушения в их функциях.
Кислотность в кишечнике:
- Нормальная кислотность в луковице двенадцатиперстной кишки 5,6–7,9 рН.
- Кислотность в тощей и подвздошной кишках нейтральная или слабощелочная и находится в пределах от 7 до 8 рН.
- Кислотность сока тонкой кишки 7,2–7,5 рН. При усилении секреции достигает 8,6 рН.
- Кислотность секрета дуоденальных желез — от рН от 7 до 8 рН.
- Кислотность панкреатического сока — от 7,5 до 9 рН.
- Кислотность сока толстой кишки 8,5–9,0 рН.
В нижних отделах толстой кишки значения pH кислотности постепенно возрастают, достигая максимального значения рН в области ректосигмоидального перехода.
- Кислотность кала в норме от 6,0 до 8,0 рН.
- Кислотность мекония (первородного кала новорожденных) — около 6 рН.
- Кислотность грудного женского молока - 6,9-7,5 pH
Кислотность крови:
Кислотность плазмы артериальной крови человека колеблется в пределах от 7,37 до 7,43 рН, составляя в среднем 7,4 рН. Кислотно-щелочное равновесие в крови человека является одним из самых стабильных параметров, поддерживающее кислые и щелочные компоненты в определенном равновесии в очень узких границах. Даже небольшой сдвиг от указанных пределов может привести к тяжелой патологии. При сдвиге в кислотную сторону, возникает состояние называемое - ацидозом, в щелочную — алколозом. Изменение кислотности крови выше 7,8 рН или ниже 6,8 рН несовместимо с жизнью.
Кислотность эритроцитов составляет 7,28–7,29 рН.
Нормальная кровь оживляет лимфатические клетки, способные уничтожить опухолевые клетки. В организме человека имеется множество лимфатических клеток (например, клетки NK, клетки LAK). Их уникальность состоит в том, что они способны отличать нормальные клетки от больных и пораженных, и уничтожать последние. В этом и заключается функция иммунитета человеческого организма. Самая большая активность лимфатических клеток по уничтожению больных клеток проявляется при РН 7,4. Однако обычно вокруг пораженных клеток, существует более кислая среда, которая препятствует активности лимфоцитов, работающих лучше при слабо щелочном pH.
Употребляя продукты питания, обладающие защелачивающим действием, можно корректировать баланс РН в пределах 0,5 единиц, создавая благоприятную среду для воздействия лимфоцитов и уничтожения пораженных или аномально построенных клеток.
Раковая ткань имеет повышенную кислотность в отличие от нормальной ткани и организм защищает её фиброзной оболочкой у которой pH щелочной. Если продолжать применять кислую диету, оболочка растворяется, и раковые клетки выпускаются наружу.
КАК ПРОВЕРИТЬ СРЕДУ СВОЕГО ОРГАНИЗМА САМОСТОЯТЕЛЬНО
1. Проверить водородный показатель (рН) - реакцию слюны и мочи по шкале цветной индикаторной (лакмусовой) бумажки. Если слюна и моча находятся в пределах рН 5,0-5,7, существует предрасположенность к онкологическим заболеваниям, но это не значит, что человек заболеет. Если слюна и моча в пределах рН 7,0-7,4 вы защищены от онкологических заболеваний.
2. Можно сделать биоимпедансный анализ (диагностика состава тела). По количеству воды, находящейся в связанном состоянии, вы определите, существует ли у вас смещение кислотно-щелочного баланса. Если переизбыток такой воды – однозначно кислая среда, недостаток - щелочная.
ЕСЛИ ОРГАНИЗМ ЗАКИСЛЕН:
В наше время это наблюдается очень часто в связи с неверным питанием и отношением к своему организму.
К закислению организма в первую очередь приводит:
- преобладание в питании таких продуктов, как сахар, мясо, курица, рыба, сладости, пастеризованные молочные продукты, мучные изделия и крупы;
- второй фактор - потребление несовместимых пищевых продуктов, например, белков с углеводами;
- окислителями также являются многие консерванты и пищевые добавки, которыми так богаты современные продукты, особенно с большим сроком хранения;
- алкогольные напитки;
- кофе, чай, шоколад, табак.
Для защелачивания крови организм расходует минеральные вещества - кальций, натрий, калий, железо, магний. А это ведет к физической слабости, быстрой утомляемости, снижению умственной деятельности и бессоннице, раздражительности и депрессивным состояниям. Вымывание кальция из костной ткани служит причиной тяжелой болезни - остеопороза.
Что делать, если организм закислен:
Ежедневный рацион здорового человека должен включать не менее 75-85 % ощелачивающих пищевых продуктов, а в питании человека, страдающего каким-либо заболеванием, их доля должна быть увеличена до 90 %. К ощелачивающим продуктам относятся овощи и фрукты. И именно в такой последовательности, а не наоборот, поскольку существует негласное правило: чем ближе овощ или фрукт к поверхности почвы, тем выше в нем содержание подщелачивающих макроэлементов (например, калия). Калий, содержащийся в картофеле с кожурой, базилике, кураге, многих других овощах и фруктах, помогает бороться с закислением (латентным ацидозом) и создавать благоприятные условия для усвоения питательных веществ и лекарственных препаратов. Наиболее полезны в этом смысле свежие помидоры, свекла, курага, дыни. Более эффективно ощелачивают кровь свежеприготовленные овощные или фруктовые соки. Самые полезные - морковный, сельдереевый и арбузный.
В овощах и фруктах доминируют щелочные валентности, поэтому их употребление устраняет ацидоз.
В ваше меню обязательно должны входить тертые сырая свекла и морковь, мелко нарезанная капуста, укроп, сельдерей, лук и чеснок. Очень полезно употреблять в пищу молодые зеленые побеги растений, мед, травяные чаи, соевый соус, морские водоросли, проростки пшеницы.
Один раз в неделю желательно устраивать себе разгрузочные дни, употребляя в пищу только сырые овощи и фрукты или даже в один из таких дней пить только соки и пюре.
Большая часть бобовых и круп, за исключением гречки и проса, при обычном приготовлении повышает кислотность крови. Однако после замачивания или проращивания они приобретают ощелачивающее действие. Сырые орехи и семена нужно замачивать за полчаса до еды, крупы - за 0,5-2 часа перед варкой, бобовые - на ночь.
При смещении кислотно-щелочного равновесия в щелочную сторону (как правило, это можно наблюдать у вегетарианцев) в тканях создается нехватка воды, кожа становится сухой и обезвоженной. Всему должна быть мера.
Физическая работа и спорт немного смещает реакцию организма в щелочную сторону.
Немаловажное значение имеет настроение человека. Хорошее веселое настроение нормализует кислотно-щелочное равновесие.
Один раз в неделю, при закислении организма, желательно устраивать себе лечебные дни, употребляя в пищу только овощи (1,5 кг овощей, разделяя на весь день), в летний период вареные и иногда сырые, в осеннее-зимний только термически обработанные) и обязательно чистую горячую воду.
Если вы заболели, необходимо отказаться от любой мясной пищи и от бульонов.
Если вам предстоит операция, ее нужно делать в щелочном режиме организма, после операции соблюдать растительную диету.
Обратите внимание - защелачивающие продукты (к примеру, фрукты), употребляемые с сахаром (сильным закислителем) -закисляют организм (кровь).
ПРОДУКТЫ ЗАКИСЛЯЮЩИЕ И ЗАЩЕЛАЧИВАЮЩИЕ:
Степень их действия отметим количеством плюсов:
Некоторые продукты, закисляющие организм: сахар! (+++), дичь (++++), устрицы (++++), раки (++++), телятина (+++), яйца (+++), цыплята (+++), рыба (++), мидии (+++), кофе (+++), варенье (+++), бобы запеченные (+++), печень говяжья (+++), свинина нежирная (++), бекон тощий (++), ветчина (++), сливы маринованные (++), бананы зеленые (++), горох сушеный (++), мука белая (++), ячневая крупа (++), мамалыга и кукурузные хлопья (++), крахмал (++), арахис (++), сыр твердый (++), хлеб белый (++), баранина вареная (++), баранина тушеная (+), хлеб черный (+), бобы сушеные (+), сыр мягкий (+), сливки (+), говядина (+), бекон жирный (+).
Некоторые продукты, защелачиваюшие организм: инжир (++++), свекла свежая (++++), сельдерей (++++), ягоды (++++), грейпфрут (++++), лук латук (++++), шампиньоны (++++), помидоры свежие (++++), абрикосы сушеные (++++), абрикосы свежие (+++), груши (+++), облепиха (+++), лимон (если он употребляется без сахара) (+++), апельсин (+++),арбуз (+++), дыня (+++), чернослив (+++), перец (+++), бобы свежие (+++), смо¬родина (+++), капуста (все виды) (+++), фисташки (+++),огур¬цы (+++), одуванчик (листья) (+++), пастернак (+++), сливы (+++), персики (+++), молоко цельное (+++), кумыс (+++), сыворотка молочная (+++), бананы спелые (++), яблоки (++), виноград (.++), вишня (++), изюм (++), финики (++), лук (++), зеленый горошек (++), редис (++), миндаль (++), морковь (++), картофель с кожурой (++), клюква (+), спаржа (+), сало свиное (+). опубликовано econet.ru
pH воды и его значение для каждого из нас
Питьевая вода должна соответствовать нормам, которые гарантируют ее безопасность для человека. Показатель pH воды показывает кислотность жидкости за счет выявления в ней ионизированного водорода. Для получения этого показателя специалисты проводят химический и микробиологический анализ воды. Это необходимо для определения содержания ионов водорода на литр жидкости. От содержания водорода зависит кислотность воды, а значит и ее пригодность для использования.
Для питьевой воды проверка pH воды является важной процедурой. В комнатных условиях нормальным pH питьевой воды является 8-10 ммоль ионов водорода. Отклонения в ту или иную сторону сказываются на качестве жидкости. Они могут быть связаны с изменением температуры или же с самим источником жидкости. Но существуют специальные приборы, способные нормализовать этот показатель.
В свою очередь pH дистиллированной воды колеблется между 4-7 единиц. Это жидкость, которая была очищена от всех примесей и минеральных солей. Такая полностью чистая вода пригодна для употребления человеком, но не содержит полезные и необходимые для него вещества. Такое же явление может наблюдаться и при использовании различных фильтров для воды. Иногда происходит очистка не только лишних примесей, но и полезных веществ. Это одна из причин, почему приборы для нормализации кислотности воды должны подбираться индивидуально после проведения подробного исследования. Нарушение баланса воды может повлечь и нарушение ее свойств и того, как будут протекать различные химические реакции в ней.
Сейчас используются разные способы, которыми можно определить уровень pH воды. Это может быть лакмусовый индикатор, специальный прибор или вещество, добавляемое в воду. Каждый из этих способов имеет свои особенности и используется в определенном случае. Их принцип работы в основном заключается в том, что при добавлении в жидкость раствора кислоты происходит химическая реакция. И именно по ней можно судить об уровне наличия ионов в воде.
Само понятие кислотности появилось в начале 20 века. В 1909 году датский биохимик Сёренсен опубликовал ряд статей, где впервые был использован этот термин. На русский язык pH расшифровывается как «водородный показатель». Сейчас для более короткой записи используется символ pH, а не полное название термина.
Кислотность имеет не только вода. Многие бытовые и биологические материалы также обладают своими показателями кислотности. Ее можно встретить в батарейках, уксусе, газированных напитках или чашке с кофе. Минеральные поверхности, с которыми соприкасается жидкость, также способны влиять на ее кислотные показатели.
Закажите бесплатно консультацию эколога
Как произвести анализ воды на кислотность pH?
Проверка pH воды может осуществляться как в лаборатории, так и в домашних условиях. Проведение исследования в лаборатории считается более надежным вариантом. Специалисты проводят целый комплекс исследований, которые охватывает множество свойств жидкости. Результаты домашнего исследования могут быть искажены разными факторами.
В домашних условиях используют простейший измеритель pH воды. Наличие ионов водорода выявляется при помощи специальных индикаторов. В качестве индикатора выступает лакмусовая бумага, на которую нанесено химическое вещество. Вступая в контакт с жидкостью в результате реакции цвет индикатора меняется. Потом идет сопоставление цвета индикатора с цветовой шкалой, где описано какой цвет какому показателю соответствует. В простых измерителях есть всего два цвета. Они свидетельствуют только о том, повышена кислотность или нет. Даже если такой способ является достаточно точным на результаты могут повлиять различные примеси, которые попали в воду из-за нарушений правил проверки.
Для получения более точных результатов используются универсальные индикаторы, дающие представление не только о наличии повышенной кислотности, но и о ее количестве. В таких индикаторах существует не два цвета, а целая цветовая гамма. В зависимости от полученного оттенка можно судить об уровне кислотности воды. Но в этом случае важно, чтобы жидкость была чистой и не мутной. Иначе это способно затруднить проведение исследований.
Для промышленных целей значение pH воды определяется специальным прибором, который называется pH-метр. Преимущество такого прибора в том, что его можно настраивать на нужные диапазоны. Это позволяет получить максимально точные результаты, где погрешность не будет превышать 0,1 единицу на литр. Специалисты лаборатории часто используют такой прибор при анализе вод.
К наиболее эффективным методам исследования можно отнести аналитический метод проверки. Его проводят с использованием специального вещества – титрант, который является химически активным веществом. При попадании в жидкость он начинает вступать в реакцию с ионами водорода. Такое исследование начинается с того, что вещество в виде капель вводится в воду. Дальше он начинает взаимодействовать с ионами водорода и растворяться в проверяемой жидкости. Индикатор, в качестве которого выступает лакмусовая бумажка, сигнализирует о конце реакции и моменте. Судить о кислотности в этом случае можно по наличию водорода в жидкости. Если жидкость очистилась, то значит все показатели в норме. Если даже после введения титранта в жидкости остался водород, значит его содержание превышает норму. Этот вид исследования эффективен при проверке различных водоемов низкой и средней мутности.
Если анализ выявил отклонения, то стоит вопрос о том, как же привести показатели в норму. Существует несколько способов, которые используются для изменения кислотности в зависимости от условий и выявленного нарушения. При обнаружении превышения норм необходимо задуматься о том, как понизить pH воды. В этом случае используют различные приборы, растворы и другие способы понижения концентрации ионов водорода. Так же как и в первом случае только эксперты после проведения экспертизы могут сказать как повысить pH воды.
Насколько важна правильная кислотность воды?
Кислотность воды pH является важным показателем качества воды. Зачастую по одной только кислотности можно судить пригодна ли жидкость для дальнейшего использования в бытовых или промышленных целях. Жидкость всегда содержит различные примеси, которые необходимы для протекания нормальных естественных реакций. Кислотность влияет на то, как будут протекать эти реакции или процессы. Есть специальные документы, которые прописывают какой должен быть pH воды.
В производстве норма pH воды должна соблюдаться для того, чтобы вода не меняла своих свойств. Для этого существуют специальные приборы, которые поддерживают нужный показатель кислотности жидкости. Поэтому даже после того, как в жидкость добавляют различные необходимые вещества ее баланс не будет изменен.
Даже для сохранности окружающей среды необходимо проводить анализ pH воды в водоемах. Ведь от кислотности зависят химические реакции в жидкости. Если баланс будет нарушен, то и свойства воды могут измениться в результате неправильного хода химических реакций.
Ну и самое главное, что измерение pH воды нужно для того, чтобы обезопасить здоровье человека. Вода, которая употребляется внутрь должна соответствовать всем нормам, прописанным в специальных документах. Ионы водорода играют большую роль во многих жизненных процессах организма. Высокая кислотность желудочного сока позволяет осуществлять процесс пищеварения, который был бы невозможен при отсутствии кислотности. От этого также зависит состав крови, ионы водорода позволяют вырабатывать достаточное количество нуклеиновых кислот и в полной мере обновлять клетки.
Человек на 80% состоит из воды и значит, что для него большую роль имеет то, как протекают химические процессы в жидкости. Ведь ее высокое содержание в организме влияет на то, как будут протекать биохимические реакции в нем самом. Концентрация ионов водорода в организме поддерживается благодаря сложным системам организма и нарушение концентрации может сильно сказаться на организме.
Нарушение кислотности воды чревато для человека различными осложнениями:
- пониженная кислотность провоцирует заболевания желудочно-кишечного тракта, нарушение обмена веществ и многих других осложнений. Это связано с образованием кислотной среды;
- повышенная же кислотность употребляемой жидкости нередко становится причиной различных проблем с пищеварением и иммунитетом. Также это становится причиной проблем с кожей и слизистыми оболочками.
Исследовательская лаборатория «ЭкоТестЭкспресс» проводит определение pH воды в Москве. В своих исследованиях мы используем самые разнообразные новейшие технологии, в том числе и прибор для измерения pH воды. На протяжении 14 лет лаборатория занимается проведением качественных исследований на различные показатели и помогает обнаруживать опасные отклонения от нормы. Если вы хотите знать о качестве используемой вами жидкости, то такое исследование просто незаменимый помощник, который поможет предотвратить вред для здоровья.
показатель нормы дождевой и водопроводной, морской и другой воды. Как понизить и повысить уровень? Что это простыми словами?

Одним из важнейших показателей качества воды считается уровень ее pH. Этот критерий определяет наличие химических процессов, происходящих в жидкости. Уровень кислотности определяет пригодность воды к применению в той или иной сфере человеческой жизни и деятельности.
Что это такое?
Pondus Hydrogenium, или простыми словами pH воды, означает вес гидрогена. Данный показатель определяет число водородных ионов в жидкости. Идеальный показатель составляет 7 единиц, он называется нейтральным. Существуют и другие определения:
- сильнокислый – менее 3;
- кислый – от 3 до 5;
- слабокислый – от 5 до 6,5;
- нейтральный – от 6,5 до 7, 5;
- слабощелочной – 7, 5–8,5;
- щелочной – от 8,5–9, 5;
- сильнощелочной – 9,5–11.
Уровень pH воды влияет на свойственные и качественные характеристики жидкости. Его величина определяет характер прохождения всевозможных реакций в воде, а также ее коррозийную агрессивность, токсичность загрязняющих веществ и иные факторы. Помимо всего вышеперечисленного, кислотно-щелочной баланс используемой воды способен оказать влияние на состояние человеческого здоровья, а также на настроение и самочувствие. Специалисты должны постоянно следить за показателем pH в водопроводе.
Если в воду с нормальными характеристиками случайным образом попадет медь, то употребление такой жидкости может нанести вред человеческому здоровью. Проявляется негативное воздействие поражением печени, особенно у детей.
Показатели нормы
По правилам СанПин нормальный рН водопроводной воды из крана составляет от 6,5 до 8,5 единиц. Однако потребителю стоит помнить, что значение этого показателя может отличаться в зависимости от характера применения.
Таблица норм уровня pH воды
Помимо этого, известны и другие нормы данного показателя для разного типа воды, безопасные для человека:
- дождевой – менее 7;
- морской – 7,5–8,5;
- речной, озерной и других поверхностных пресных водоемов – 6,5–8,5.
Согласно требованиям норма чистой дистиллированной жидкости должна равняться от 6,5 до 8,5 единиц. Если брать во внимание pH талой воды, то он должен равняться 7. Последний должен быть нейтральным, а не щелочным или с высокой кислотностью.
Показатель pH кипяченой минеральной бутилированной или водопроводной воды после кипячения обычно увеличивается, это стоит брать во внимание людям, у которых есть хронические заболевания.
Как измерить?
Определить показатель pH воды можно в домашних условиях, а также в лаборатории, используя различные методики. С этой целью могут использоваться индикаторы, датчики, тесты, электромеханические изобретения, pH-метры.
- Лакмусовая бумага. Этот способ относится к самым простым и доступным. В основе метода лежит лакмусовый краситель, определяющий уровень pH воды. Лакмус является красителем растительного происхождения, в кислоте он приобретает красную окраску, а в основании – синюю.
- pH-метр, который позволяет определить кислотность с особой точностью. Этот прибор работает на потенциометрическом принципе. Обычно приспособлением пользуются при необходимости точного определения уровня кислотности в насыщенном растворе, а именно: поверхностной, водопроводной, минеральной водах, аквариуме, бассейне. Жидкость, которую требуется исследовать, отправляют в стеклянный электрод pH-метра. В результате такой манипуляции возникает гальваническое напряжение между границами электрода из стекла. Сила напряжения напрямую зависит от кислотности воды. Электромагнитную силу измеряют благодаря использованию 2-х электродов сравнения. Водные pH-метры представлены бытовым и лабораторным типами. Зачастую люди пользуются первыми разновидностями. Они могут отличаться друг от друга степенью защиты от жидкости, автоматической калибровкой, а также точностью измерения.
- Тест-полоски. На практике распространено использование материала в виде полоски, которая пропитана специальной смесью, имеющей в составе универсальный индикатор. В раствор для тестирования опускают подготовленную полоску, которая впоследствии окрашивается в определенный цвет. Уровень pH воды можно определить с помощью специальной шкалы, красный цвет которой свидетельствует о высокой кислотности, а синий – об ощелоченности жидкости. Точность измерения кислотного интервала составляет от 1 до 2 единиц. Тест-полоски можно сделать своими руками в домашних условиях. К примеру, можно воспользоваться веществами, которые способны сменить окраску в зависимости от наличия определенного количества Н2.
К примеру, при добавлении кислого лимона в чай напиток из коричневого превращается в желтый. Также способны поменять свой цвет соки вишни и смородины.
Как повысить?
Уровень кислотности воды может меняться, даже на протяжении суток. Иногда может возникнуть необходимость поднять уровень pH. С этой целью можно использовать четыре метода.
- Положить в искусственный водоем камни горных пород либо мелкие кораллы. Такой способ увеличить щелочной баланс воды нашел свое применение в африканском цихлидном аквариуме.
- Поместить в фильтровый отсек немного известняка. В ходе процедуры требуется постоянно наблюдать за кислотностью, чтобы не превысить допустимые нормы.
- Сделать процесс аэрации более интенсивным. Благодаря этому уровень СО2 будет существенно снижен, а pH воды возрастет.
- Разбавить жидкость пищевой содой. Чтобы нормализовать качество жидкости в объеме 30 литров, потребуется 1 чайная ложка натрий гидрокарбоната. В случае превышения вышеуказанной нормы может произойти гибель жителей искусственного водоема.
Насыпать соду прямо в аквариум категорически запрещено – ее требуется изначально растворить в небольшом количестве воды.
Как понизить?
Показатель кислотности раствора, именуемый pH, показывает концентрацию в ней водородных ионов. Оптимальным показателем, то есть нейтральным, считается 7 единиц, но в некоторых случаях может возникнуть необходимость его снизить. Довольно часто это случается в быту, например для нормальной жизнедеятельности аквариумных рыбок. Чтобы уменьшить высокий показатель, потребителю потребуется подготовить полосы индикаторной бумаги, подкисленную воду, буферный грунт, СО2, а также деревянный брусок.
Приведем пошаговую схему процесса.
- В первую очередь потребуется узнать точный показатель кислотности воды, который необходим для существования домашних рыбок. Этот момент можно уточнить, прочитав специальную литературу, в которой описаны правильные условия для нормальной жизнедеятельности того или иного вида водных жителей.
- В магазине необходимо купить индикаторные полоски, благодаря которым получится провести оценку кислотности воды. По мнению специалистов, лучше использовать pH-метр. Последний можно найти в любой лаборатории.
- Если уровень pH высокий, то в нее можно добавить воду с невысокой кислотностью. Предварительно объем воды стоит правильно рассчитать. Реагентом в данном случае может выступать ортофосфорная кислота. Подкисленную жидкость рекомендуется добавлять малыми порциями и при этом хорошо перемешивать. Помимо этого, после каждого введения подкисленной жидкости стоит контролировать уровень кислотности в веществе. В противном случае может получиться вода, которая непригодна для жизни рыбок.
- В специализированном магазине можно купить грунт буферного типа, добавление которого в воду сможет нормализовать уровень pH в ней. Использование такого вещества способствует постепенному снижению показателя кислотности. Проведение данной процедуры требует постоянного контроля и измерений числа водородных ионов.
- Довольно эффективным методом нормализации кислотности аквариумной воды является введение в нее СО2. Такое мероприятие можно провести при помощи специального устройства либо баллончика, где углекислый газ находится под действием давления.
- Некоторые люди пользуются простым, но довольно эффективным методом, который заключается в использовании деревянного бруска. Древесину стоит заблаговременно обработать и поместить в аквариум. Такая манипуляция не только снизит pH воды, но и украсит искусственный водоем. Как вариант можно использовать коряги, которые также опускают в воду. После этого будет происходить постепенная нормализация кислотности, благодаря чему у рыбок не будет шока, они не погибнут от стресса.
- При помощи отвара коричневых шишек ольхи также можно снизить pH. Насыщенность вещества напрямую зависит от числа шишек. Для быстрого подкисления аквариумной воды рекомендуется влить в нее отвар шести ольховых шишек. По прошествии 17 суток вода сможет существенно снизиться по кислотности.
Если вышеперечисленные методы не помогают, то стоит обратить внимание на карбонатную жесткость воды. Она может быть причиной, по которой кислотность не снижается. В этом случае стоит изначально очистить жидкость путем обратного осмоса, благодаря чему резко упадет уровень содержания минералов.
Значение pH воды важно не только для водопроводов, но и для человеческого здоровья. По этой причине стоит постоянно контролировать данный показатель, а также при необходимости корректировать его.
Вода с высоким содержанием кислоты или щелочи может нанести вред не только человеческому здоровью, но и растениям, животным.
pH и вода
• Школа наук о воде HOME • Темы о свойствах воды • Темы о качестве воды •
pH и вода
Нет, вы не часто слышите, как местный новостной телеканал говорит: «Ребята, сегодняшнее значение pH Dryville Creek составляет 6,3!» Но pH - довольно важный показатель воды. Может быть, для научного проекта в школе вы взяли pH образцов воды на уроке химии ... а здесь, в Геологической службе США, мы измеряем pH всякий раз, когда изучается вода.Мало того, что pH ручья влияет на организмы, живущие в воде, изменение pH в ручье может быть индикатором увеличения загрязнения или какого-либо другого фактора окружающей среды.
pH: единицы определения и измерения
Кстати ..... для того, чтобы раствор имел pH, он должен быть водным (содержать воду). Таким образом, у вас не может быть pH растительного масла или алкоголя.
pH - это показатель кислотности / щелочности воды. Диапазон составляет от 0 до 14, где 7 нейтрально.pH менее 7 указывает на кислотность, тогда как pH более 7 указывает на основание. pH на самом деле является мерой относительного количества свободных ионов водорода и гидроксила в воде. Вода с большим количеством свободных ионов водорода является кислой, тогда как вода с большим количеством свободных гидроксил-ионов является основной. Поскольку на pH могут влиять химические вещества в воде, pH является важным показателем химического изменения воды. pH указывается в «логарифмических единицах». Каждое число означает 10-кратное изменение кислотности / щелочности воды.Вода с рН пять в десять раз более кислая, чем вода с рН шесть.
Важность pH
pH воды определяет растворимость (количество, которое может быть растворено в воде) и биологическую доступность (количество, которое может быть использовано водными организмами) химических компонентов, таких как питательные вещества (фосфор, азот и углерод) и тяжелые металлы (свинец , медь, кадмий и др.). Например, помимо влияния на то, сколько и какая форма фосфора наиболее распространена в воде, pH также определяет, могут ли водные организмы использовать его.В случае тяжелых металлов степень их растворимости определяет их токсичность. Металлы имеют тенденцию быть более токсичными при более низком pH, потому что они более растворимы. (Источник: Путеводитель для гражданина по пониманию и мониторингу озер и ручьев)
Диаграмма pH
Как показано на этой диаграмме, pH находится в диапазоне от 0 до 14, где 7 является нейтральным. pH меньше 7 является кислым, а pH больше 7 - щелочным (основным). Нормальные осадки имеют pH около 5,6 - слабокислый из-за углекислого газа из атмосферы .Вы можете видеть, что кислотный дождь может быть очень кислым и может негативно повлиять на окружающую среду.
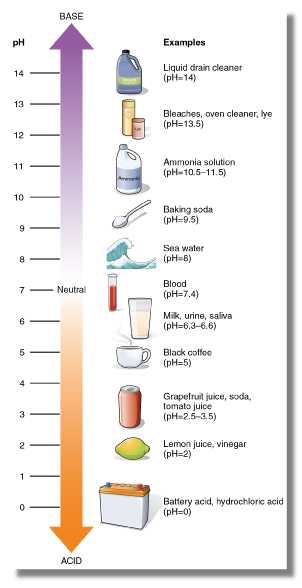
Шкала pH варьируется от 0 до 14, где 7 - нейтральный. pH меньше 7 является кислым, а pH больше 7 - щелочным (основным).
Кредит: robin_ph / stock.adobe.com
Измерение pH
Геологическая служба США ежегодно анализирует сотни тысяч проб воды. Многие измерения проводятся прямо в полевых условиях, и еще больше - на пробах воды в лаборатории.pH - важное измерение воды, которое часто измеряется как на месте отбора проб, так и в лаборатории. Есть большие и маленькие модели pH-метров. Доступны портативные модели, которые можно взять с собой в поле, а более крупные модели, такие как эта, используются в лаборатории.
Для использования pH-метра на фотографии ниже образец воды помещается в чашку, а стеклянный зонд на конце выдвижного рычага помещается в воду. Внутри тонкой стеклянной колбы на конце зонда есть два электрода, измеряющих напряжение.Один электрод находится в жидкости с фиксированной кислотностью или pH. Другой электрод реагирует на кислотность пробы воды. Вольтметр в зонде измеряет разницу между напряжениями двух электродов. Затем измеритель переводит разницу напряжений в pH и отображает ее на маленьком экране основного блока.

Портативный электронный pH-метр.
Перед измерением pH измеритель должен быть «откалиброван». Зонд погружают в раствор с известным pH, например чистую воду с нейтральным pH 7.0. Ручки на коробке используются для регулировки отображаемого значения pH до известного значения pH раствора, таким образом калибруя прибор.
Измерение pH дома или в школе
Один из самых популярных школьных научных проектов - это измерение pH воды из разных источников. Скорее всего, в вашей школе (и, конечно, не у вас) нет электронного pH-метра, но вы все равно можете получить оценку pH с помощью лакмусовой бумаги. Лакмусовая бумага, которую можно найти в магазинах зоотоваров (для проверки уровня pH в аквариумах), представляет собой просто полоску бумаги, которая, когда на нее падает образец воды, приобретает определенный цвет, что дает приблизительную оценку pH.
pH и качество воды
Чрезмерно высокие и низкие значения pH могут отрицательно сказаться на использовании воды. Высокий pH вызывает горький вкус, водопроводные трубы и водопроводные приборы покрываются отложениями , что снижает эффективность дезинфекции хлора, вызывая потребность в дополнительном хлоре при высоком pH. Вода с низким pH разъедает или растворяет металлы и другие вещества.
Загрязнение может изменить pH воды, что, в свою очередь, может нанести вред животным и растениям, живущим в воде.Например, вода , выходящая из заброшенной угольной шахты , может иметь pH 2, который очень кислый и определенно повлияет на любую рыбу, достаточно сумасшедшую, чтобы попытаться жить в ней! Если использовать логарифм, то эта шахтная дренажная вода будет в 100000 раз более кислой, чем нейтральная вода, поэтому держитесь подальше от заброшенных шахт .
Изменение pH в США
pH осадков и водоемов сильно различается по территории Соединенных Штатов.Естественные и человеческие процессы определяют pH воды. Национальная программа атмосферных отложений разработала карты, показывающие модели pH, такие как приведенная ниже, показывающая пространственную картину pH осадков на полевых участках за 2002 год. Вы должны знать, что эта контурная карта была разработана с использованием измерений pH при конкретном отборе проб. локации; таким образом, изолинии и изолинии были созданы с использованием интерполяции между точками данных. Вам не обязательно использовать карту для документирования pH в других конкретных точках карты, а, скорее, использовать карту как общий индикатор pH по всей стране.
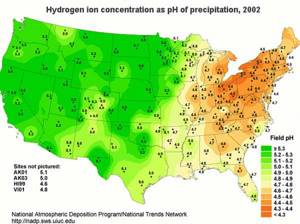
Примечание. На этой карте показан один момент времени, и с 2002 года наблюдается общее сокращение количества факторов, вызывающих кислотные дожди. Более новая карта может сильно отличаться от этой. Тем не менее, более низкие значения pH осадков по-прежнему будут наблюдаться на северо-востоке США
..
Веб-страница не найдена на InspectApedia.com
.
Что делать, если ссылка на веб-страницу на InspectApedia.com приводит к ошибке страницы 404
Это так же просто, как ... ну, выбирая из 1, 2 или 3
- Воспользуйтесь окном поиска InspectAPedia в правом верхнем углу нашей веб-страницы, найдите нужный текст или информацию, а затем просмотрите ссылки, которые возвращает наша пользовательская поисковая система Google
- Отправьте нам электронное письмо напрямую с просьбой помочь в поиске информации, которую вы искали - просто воспользуйтесь ссылкой СВЯЗАТЬСЯ С НАМИ на любой из наших веб-страниц, включая эту, и мы ответим как можно скорее.
- Используйте кнопку НАЗАД вашего веб-браузера или стрелку (обычно в верхнем левом углу экрана браузера рядом с окном, показывающим URL-адрес страницы, на которой вы находитесь), чтобы вернуться к предыдущей статье, которую вы просматривали. Если вы хотите, вы также можете отправить нам электронное письмо с этим именем или URL-адресом веб-страницы и сообщить нам, что не сработало и какая информация вам нужна.
Если вы действительно хотите нам помочь, используйте в браузере кнопку НАЗАД, затем скопируйте URL-адрес веб-страницы, которую вы пытались загрузить, и используйте нашу ссылку КОНТАКТЫ (находится как вверху, так и внизу страницы), чтобы отправьте нам эту информацию по электронной почте, чтобы мы могли решить проблему.- Благодаря.
Приносим свои извинения за этот SNAFU и обещаем сделать все возможное, чтобы быстро ответить вам и исправить ошибку.
- Редактор, InspectApedia.com
Задайте вопрос или введите условия поиска в поле поиска InspectApedia чуть ниже.
Мы также предоставляем МАСТЕР-ИНДЕКС по этой теме, или вы можете попробовать верхнюю или нижнюю панель ПОИСКА как быстрый способ найти необходимую информацию.
Зеленые ссылки показывают, где вы находитесь. © Copyright 2017 InspectApedia.com, Все права защищены.
Издатель InspectApedia.com - Дэниел Фридман .Что нужно знать о pH воды
В чистом виде вода имеет pH 7, что соответствует точному центру шкалы pH. Частицы в воде могут изменять pH воды, и большая часть используемой воды имеет pH от 6,5 до 8,5.
Есть несколько важных вещей, которые нужно понять о шкале pH и о том, как она соотносится с водой. Например, возможно, что употребление щелочных напитков принесет пользу для здоровья.
Продолжайте читать, чтобы узнать больше о pH воды.
В химии pH - это измерение концентрации ионов водорода в растворе на водной основе. Более низкий pH означает, что в жидкости больше ионов водорода, тогда как более высокий pH указывает на меньшее количество ионов водорода в жидкости.
Проще говоря, pH - это шкала от 1 до 14, которая измеряет кислотность или щелочность жидкости. В середине шкалы находится чистая дистиллированная вода с нейтральным pH, равным 7. Все, что имеет pH ниже 7, является кислотой, а все, что pH выше 7, является щелочью или основанием.
Если использовать повседневные примеры, уксус очень кислый, с pH около 2. И наоборот, отбеливатель очень щелочной, с pH около 13,5.
Важно отметить, что эта шкала применима только к жидкостям на водной основе.
pH играет важную роль в свойствах жидкости, содержащей воду.
Например, pH воды может сделать определенные элементы в ней, такие как минералы и металлы, более или менее доступными для организма. Тяжелые металлы в воде с более низким pH, как правило, более токсичны, поскольку они более доступны для организма.Высокий pH сделает тяжелые металлы менее доступными и, следовательно, менее токсичными.
Уровень pH также может быть признаком наличия в жидкости других загрязнителей или бактерий. Как правило, очень высокий или очень низкий pH может сделать воду непригодной для определенных применений.
Например, жесткая вода - это общий термин для воды, содержащей много минералов. Эти минералы делают воду очень щелочной. Когда вода проходит через трубы и устройства, использующие воду, такие как посудомоечные машины или душевые, эти минералы прилипают как к трубам, так и друг к другу, что приводит к накоплению минералов.
Накопление минералов может вызвать различные проблемы с водой в доме, например, сделать моющие средства и мыло менее эффективными. Это также может привести к снижению давления воды или даже засорению.
С другой стороны, вода с низким pH может вызывать коррозию металлических труб и выделять ионы металлов в воду, что делает ее вредной для питья или использования в домашних условиях.
В большинстве случаев вода, которую поставщики намереваются использовать или пить, будет ближе к нейтральной точке 7, хотя она все еще может немного отличаться.Агентство по охране окружающей среды (EPA) рекомендует поддерживать pH в пределах от 6,5 до 8,5 в питьевой воде, и многие штаты в США предпочитают устанавливать эти уровни.
Питьевая вода и другие напитки на водной основе с различным уровнем pH могут влиять на несколько различных факторов здоровья.
Щелочная вода и другие щелочные продукты приобрели популярность в последние годы, став новой тенденцией в области здравоохранения. По словам сторонников щелочных напитков, кислая среда в организме вызывает несколько хронических заболеваний, которые, как они утверждают, не могут сохраняться в щелочной среде.
Идея заключается в том, что употребление щелочной воды помогает организму стать более щелочным, что излечивает ряд заболеваний, включая рак.
Однако существует мало доказательств, подтверждающих эти утверждения. Хотя употребление щелочной воды может временно повлиять на pH рта или мочи, нет никаких научных доказательств того, что это изменит общий pH тела.
Организм строго регулирует уровень pH. Изменения внутреннего pH организма, например pH крови, могут означать серьезные проблемы в органах и тканях.Итак, если бы можно было изменить pH тела с помощью еды и питья, это было бы опасно.
Однако щелочная вода может быть полезна некоторым людям. В общем, щелочная вода имеет тенденцию быть более щелочной, потому что в ней есть минералы и электролиты. По этой причине употребление этой воды после тренировки или во время болезни может помочь сохранить баланс минералов и электролитов и предотвратить обезвоживание.
Кроме того, результаты небольшого исследования показывают, что людям с кислотным рефлюксом может быть полезно пить щелочную воду с pH 8.8. Исследователи обнаружили, что щелочная вода, по-видимому, навсегда деактивирует фермент, который играет роль в изжоге, что может уменьшить симптомы.
Исследователи также обнаружили, что питьевая вода с pH 8,5–10 может быть полезной для людей с синдромом раздраженного кишечника (СРК), основным симптомом которого является диарея. Люди, которые пили воду с pH 8,5–10, имели более высокие оценки качества жизни по самооценке через 8 недель, чем те, кто этого не делал.
Однако это небольшие исследования, и необходимы дополнительные исследования на людях, чтобы подтвердить эти первоначальные результаты.
Узнайте больше о потенциальной пользе щелочной воды для здоровья здесь.
В лабораториях обычно используются электронные pH-метры для точного измерения pH. Однако приблизительную оценку pH можно получить с помощью лакмусовой бумаги. Лакмусовая бумага широко доступна в Интернете и в некоторых магазинах, таких как магазины здорового питания и зоомагазины.
Лакмусовая бумага - это чувствительная полоска бумаги, меняющая цвет при контакте с жидкостями на водной основе. Изменение цвета может дать приблизительную оценку pH жидкости.Однако следует иметь в виду, что это приблизительные оценки и что фактический pH жидкости все еще может отличаться от того, что указано на лакмусовой бумажке.

pH жидкости будет меняться в зависимости от ингредиентов внутри. В результате возможны колебания даже в двух очень похожих продуктах, например, в двух типах воды.
Вот несколько общих диапазонов pH для различных напитков:
pH воды для питья или домашнего использования очень важен.Слишком щелочная или слишком кислая вода может повредить трубы и приборы, и, как правило, пить ее вредно.
Вода обычно колеблется от 6,5 до 8,5 по шкале pH, и это нормально. Вода, выходящая за пределы этого диапазона, может быть небезопасной для питья.
Некоторым людям может быть полезно пить щелочную воду с pH выше 8,5. К таким людям относятся люди с нарушениями пищеварения, такими как СРК. Тем не менее, прежде чем эксперты смогут сделать какие-либо общие выводы о возможных преимуществах щелочной воды, потребуются более масштабные и качественные исследования, подтверждающие эти утверждения.
.8.0 ЭКСПЕРИМЕНТ ПО ОПРЕДЕЛЕНИЮ КИСЛОТНОСТИ ВОДЫ
КИСЛОТЫ И ОСНОВАНИЯ МЕРЫ ПРЕДОСТОРОЖНОСТИ
КИСЛОТЫ И ОСНОВАНИЯ В кулинарии используются слабые кислоты и основания (их реакция заставляет печенье и хлеб подниматься).Кислоты, например, в нашем желудке, разъедают пищу или переваривают ее. Используются сильные кислоты и основания
Дополнительная информацияСвойства кислот и оснований
Лабораторная работа 22 Свойства кислот и оснований TN Standard 4.2: Студент исследует характеристики кислот и оснований. Вы когда-нибудь чистили зубы, а затем выпивали стакан апельсинового сока? Что
Дополнительная информацияph Щелочность воды
ph Щелочность воды DOC316.52.93085 На основе стандарта ISO 9963-1: 1994 ph-метрическое титрование от 0,4 до 20 ммоль / л общей щелочности 1. Введение Щелочность воды - это ее способность нейтрализовать кислоту.
Дополнительная информацияНейтрализация кислоты и основания
Balancing Act Информация для учителя Задачи В этом упражнении учащиеся нейтрализуют щелочь с помощью кислоты. Учащиеся определяют точку нейтрализации кислоты, смешанной с основанием, пока они: Узнают
Дополнительная информацияЭксперимент 16-кислоты, основания и ph
Определения кислота - ионное соединение, которое выделяет воду или вступает в реакцию с ней с образованием иона водорода (H +) в водном растворе.Они кислые на вкус и становятся красной лакмусовой бумажкой. Кислоты реагируют с некоторыми металлами, такими как цинк,
Дополнительная информацияКислоты, основания и соли
Кислоты, основания и соли 2 ГЛАВА Советы и уловки Кислоты имеют кислый вкус, а основы горькие. Индикаторы - это химические вещества, которые дают разные цвета в кислых и основных растворах. Если
Дополнительная информацияПрактическое занятие № 4 ТИТРАЦИИ
Практическое занятие №4 ТИТРОВАНИЕ Реагенты: 1.Стандартный раствор NaOH 0,1 моль / л 2. Раствор H 2 SO 4 неизвестной концентрации 3. Фенолфталеин 4. Стандартный раствор Na 2 S 2 O 3 0,1 моль / л 5. Раствор крахмала
Дополнительная информацияАнализ кислоты в уксусе
Анализ кислоты в уксусе Цель: в этом эксперименте будет проанализировано процентное содержание уксусной кислоты в уксусе, купленном в магазине, с помощью титрования. Введение: уксус можно найти практически в любом доме.Может
Дополнительная информацияph: Измерение и использование
ph: Измерение и использование Одним из наиболее важных свойств водных растворов является концентрация иона водорода. Концентрация H + (или H 3 O +) влияет на растворимость неорганических и органических
Дополнительная информацияКислотно-основное титрование
Кислотно-щелочное титрование Введение Часто химики должны ответить на вопрос, сколько чего-либо присутствует в образце или продукте.Если продукт содержит кислоту или основание, этот вопрос обычно
. Дополнительная информацияПРОЦЕДУРА DR / 4000. ХЛОРИН, свободный
ПРОЦЕДУРА DR / 4000 ХЛОР, свободный метод 10069 Метод DPD * UHR (0,1 - 10,0 мг / л как Cl 2) Область применения и применение: Для тестирования более высоких уровней свободного хлора (хлорноватистой кислоты и гипохлорит-иона) в питьевой воде
Дополнительная информацияНеполярная углеводородная цепь
НАУКА О МЫЛЕ И МОЮЩИХ СРЕДСТВАХ 2000 Дэвид А.Кац. Все права защищены. Воспроизведение разрешено в образовательных целях при условии сохранения авторских прав. ВВЕДЕНИЕ Мыло - это соль
Дополнительная информацияАНАЛИЗ ВИТАМИНА С
Цель Научиться анализировать пищу на содержание витамина С и изучать различные источники содержания витамина С. Осторожно! Обращайтесь со стеклянной посудой осторожно, чтобы не разбить ее. При использовании горелки в
Дополнительная информацияТИТРАЦИЯ ВИТАМИНА С
ТИТРОВАНИЕ ВИТАМИНА С Введение: в этой лаборатории мы будем выполнять два разных типа титрования аскорбиновой кислоты, более известной как витамин С.Первым будет кислотно-основное титрование в
. Дополнительная информацияДополнительная лекция: ОСНОВЫ ТИТРАЦИИ
Дополнительная лекция: ОСНОВЫ ТИТРАЦИИ 1 Определение и применение Титрование - это постепенное добавление раствора реагента (называемого титрантом) к аналиту до завершения реакции. Общие приложения:
Дополнительная информацияПРИГОТОВЛЕНИЕ И СВОЙСТВА МЫЛА
(адаптировано из Blackburn et al., Лабораторное руководство по сопровождению мира химии, 2-е изд., (1996) Saunders College Publishing: Fort Worth) Цель: приготовить образец мыла и изучить его свойства.
Дополнительная информацияОтзыв CHM1 к экзамену 12
Темы Решения 1. Аррениусовы кислоты и основания a. Кислота увеличивает концентрацию H + в b. Основание увеличивает концентрацию ОН - в 2. Сильные кислоты и основания полностью диссоциируют 3.Слабые кислоты и
Дополнительная информацияСвойства кислот и оснований
Свойства кислот и оснований (адаптировано из набора Flinn Scientific Acid Base Test Kit I # AP4567) Введение Аккумуляторная кислота, желудочная кислота, кислотный дождь - всего несколько кислот в нашей повседневной жизни! Что это значит, когда
Дополнительная информацияКинетика фенолфталеин-NaOH
Кинетика фенолфталеина-NaOH Фенолфталеин - один из наиболее распространенных кислотно-основных индикаторов, используемых для определения конечной точки кислотно-основного титрования.Он также является активным ингредиентом некоторых слабительных средств.
Дополнительная информацияОтчеты лаборатории аналитической химии
Формат отчетов и расчеты лаборатории аналитической химии Джон Коллинз [email protected] Измерения Аналитическая химия полностью посвящена измерению, значению этих измерений и пониманию
Дополнительная информацияАвтоионизация воды
2H 2 O H 3 O + + OH Ион гидроксония гидроксид-ион В: Но как часто это происходит? Это фундаментальная концепция всей кислотно-щелочной химии. Сколько в чистой воде воды и сколько ионов?
Дополнительная информацияМы используем в повседневной жизни большое
5 Кислоты, основания и соли В повседневной жизни мы используем большое количество веществ, таких как лимон, тамаринд, поваренная соль, сахар и уксус.У них одинаковый вкус? Напомним вкусы съедобного
Дополнительная информация .Как измерить и отрегулировать гидропонные питательные вещества
Питательные вещества в гидропонных системах
В гидропонных системах для удобрения растений используется составленная смесь питательных веществ.
Хотя питательные вещества сформулированы в соотношениях, которые отражают потребности растений, транспирация и различия культур означают, что уровни питательных веществ могут отклоняться от оптимальных значений. Системный менеджер должен управлять удобрением в системной воде, чтобы максимизировать рост растений.
Если у вас есть гидропонная система, этим менеджером являетесь вы.Есть несколько удобных способов протестировать систему. Давайте узнаем, что это такое.
Доктор Нейт попросил, чтобы фермер-выскочка Гайдн Кристенсен, опытный фермер, занимающийся гидропоникой, провел нас через процесс тестирования гидропонной системы. Гайдн проверяет свою систему раз в день. Частота, с которой вы тестируете свою систему, особенно важна, если ваша система небольшая, поскольку меньшие системы колеблются сильнее, чем большие системы.
Основные измерения: pH и EC
Два основных измерения, которые необходимо провести производителю гидропоники, - это уровень pH и EC.И то, и другое можно сделать с помощью счетчиков.
pH является мерой кислотности системы и определяет, как растения и другие организмы взаимодействуют с различными питательными веществами. Каждая культура имеет определенный диапазон pH, но большинство трав и зелени перекрываются в этом диапазоне. Старайтесь поддерживать pH между 5,5 и 6,5, не меняя более 0,5 в день. (Резкие изменения могут шокировать растения.)
EC - это показатель солей в вашей системе, то есть уровень питательных веществ в вашей системе.ЕС следует поддерживать в пределах от 1,2 до 2,0.
ИзмерителиEC и pH доступны по цене и часто поставляются как один двойной измеритель. Гайдн использует двойной измеритель Bluelab.
Регулировка pH так же проста, как добавление раствора кислоты или основания
Если вы не используете фильтр обратного осмоса вместе с кислым раствором, вам редко придется беспокоиться о повышении pH. Более вероятно, что вам придется снизить pH. В то время как понижение pH в аквапонике требует нескольких шагов, в гидропонике понизить его просто.Вы можете использовать буфер pH, например pH Down от General Hydroponics, добавленный в вашу систему в определенном количестве, которое зависит от того, насколько вы хотите понизить pH.
Если вам все же необходимо поднять pH, вы можете использовать добавку основания вместо добавления кислоты.
Совет: Если ваш pH ведет себя странно или вызывает затруднения, возможно, у вас проблема с карбонатами.
Ключ к ЕС - разведение
Вы можете легко снизить ЕС, разбавив вашу систему пресной водой.Периодически проводите измерения, добавляя воду, пока она не смешается до уровня коррекции.
Вы можете повысить ЕС, добавив удобрения.
Был ли этот пост полезным? Оставляйте идеи и вопросы в комментариях ниже!
.Что такое закисление океана? | НАСА Climate Kids
Краткий ответ:
Подкисление океана - это изменение свойств воды океана, которое может быть вредным для растений и животных. Ученые заметили, что океан становится более кислым, так как его вода поглощает углекислый газ из атмосферы.
Океанские волны у побережья Новой Зеландии. Кредит: Общественное достояние
Вы когда-нибудь слышали, чтобы вода называлась «H 2 O»? Это прозвище означает, что вода представляет собой комбинацию двух химических веществ, называемых водородом (H) и кислородом (O).Вся вода содержит водород и кислород. Однако в большинстве воды есть и другие вещества.
Например, в океанской воде есть соль, а в речной или озерной - нет. Количество соли - это одна из характеристик или свойств воды. Это свойство очень важно для живых существ. Большинство пресноводных растений и животных не могут выжить, если вода слишком соленая, а большая часть океанской жизни не может выжить в пресной воде рек и озер.
Рыба-клоун должна жить в соленой океанской воде, чтобы выжить.Кредит: Общественное достояние
Вода также обладает другими свойствами, которые должны оставаться в равновесии для процветания живых существ. Одно из таких свойств называется , кислотность .
Что такое кислотность?
Кислота - это вещество, которое может вызывать определенные изменения в сочетании с водой или металлом. Кислотность - это количество кислоты в воде.
Лимонный сок и уксус - примеры продуктов, содержащих кислоты. Кислота в лимонном соке делает его кислым на вкус.
Кислоты могут вызывать химические реакции при контакте с металлом, камнями или другими поверхностями. Известно, что химические реакции разъедают, растворяют или повреждают другие вещества.
Металл, контактирующий с кислотой, может образовывать ржавчину на поверхности. Кредит: Общественное достояние
Кислотность вещества измеряется с помощью шкалы pH . Вещество с pH 7 считается нейтральным. Кислота имеет pH менее 7. Все, что имеет pH выше 7, называется основанием .
Вот список того, как повседневные вещи измеряются по шкале pH:
- 0: аккумуляторная кислота
- 1: желудочная кислота
- 2: Уксус
- 3: Апельсиновый сок
- 4: Томатный сок
- 5: Кофе
- 6: Молоко
- 7: Чистая вода
- 8: Океанская вода
- 9: Зубная паста
- 10: Мягкое моющее средство
- 11: Мойщик окон
- 12: Выпрямители для волос
- 13: Блич
- 14: Очиститель слива
Что вызывает закисление океана?
Океанская вода имеет pH примерно 8.Предоставлено: NASA / JPL-Caltech
.Как вы, вероятно, заметили в приведенном выше списке, уровень pH воды в океане равен примерно 8. Это означает, что вода в океане довольно нейтральна и слегка щелочна. Однако за последние 100-200 лет ученые заметили, что вода в океане стала на 30 процентов более кислой.
Почему это происходит? Что ж, многие виды деятельности человека, такие как выхлопные газы автомобилей и заводов, выделяют в воздух газ, называемый углекислым газом. Избыток двуокиси углерода может вызвать проблемы в атмосфере, а также может повлиять на кислотность океана.
Избыточный углекислый газ в атмосфере поглощается верхним слоем океана. А когда углекислый газ поглощается водой, он делает воду более кислой.
Почему имеет значение закисление океана?
Коралловые рифы важны для экосистем океана. Предоставлено: Грег Макфолл / NOAA
.Так же, как кислоты могут вызывать ржавчину и другие повреждения поверхностей на суше, кислая океанская вода может поражать поверхности под водой. Кислоты могут разрушать панцири животных, обитающих в море.Поскольку вода в океане стала более кислой, некоторые животные, такие как некоторые устрицы и моллюски, больше не могут производить или хранить свои раковины.
Например, кислая вода океана может замедлить рост кораллов и ослабить коралловые рифы. Эти рифы являются важным домом для многих живых существ. Их здоровье важно для многих экосистем.
Как НАСА изучает закисление океана?
Красные области на этой карте - это точки с высоким уровнем углекислого газа в атмосфере.Карта была создана с использованием информации, собранной спутником НАСА OCO-2. Предоставлено: NASA / JPL-Caltech
.спутников НАСА находятся на орбите и постоянно собирают информацию о Земле. Один спутник, названный Orbiting Carbon Observatory-2 (OCO-2), собирает информацию о двуокиси углерода в нашей атмосфере, когда он вращается вокруг Земли.
Ученые могут использовать эти измерения, чтобы лучше понять взаимосвязь между углекислым газом и изменениями кислотности океана.
.
 Категории
Категории Корзина
Корзина Информация
Информация Хиты продаж
Хиты продаж